电压与自由能

在前面的学习中,我们已经深入了解了自由能对生物过程的驱动作用。然而,自由能并非只有一种表现形式。现在我们要探讨一种特殊且举足轻重的自由能类型——电化学能。你有没有想过,为什么手机能够充电、汽车电瓶能驱动整辆车,甚至我们的思想能产生与传递?无一例外,这些都涉及电化学能的转换与利用。在生命系统中,电化学能的意义更为重大,它不仅维持细胞活动的基本运行,更是神经信号传递、肌肉运动以及多种新陈代谢现象的根本驱动力,是真正连接物理世界与生命活动的“桥梁”。
生物体中的电化学现象

从日常生活到分子世界
冬天取暖时我们使用的暖宝宝,内部的铁粉氧化反应释放热量为我们带来温暖。其实类似的能量转化,在我们的细胞里也在不停发生,只不过交换的不是热,而往往是电子和电化学能。在生命体内,大多数这样的氧化还原反应不是为了产热,而是为了实现高度组织的能量存储与利用。
细胞被称为“化学工厂”绝非浪得虚名,而它最重要的“发电机”就是线粒体。举个例子:我们餐桌上的米饭消化吸收后,葡萄糖等养分被送入细胞,经历糖酵解、柠檬酸循环等环节,最终在线粒体完成与氧结合的氧化反应。这并非一场简单的燃烧,而是一系列高度精密、逐步进行的电子转移,确保能量被有序、高效释放与储存。这也是为什么生物体的能量转化效率通常远高于人类制造的机器。
如果把细胞比作一个充满微型零部件的工厂,那么电子的流动就是车间动力的重要来源,这些微小而宝贵的流动维系着我们生命的每一刻。
氧化还原反应的本质
氧化还原反应的实质是电子在不同分子间的转移。当一个分子失去电子时称为被氧化,反之,获得电子则被还原。这种交换就像一场无形的“电子接力”,分子之间将电子传递下去。
在氧化还原反应中,电子总是从能量较高(或还原能力更强)的分子流向能量较低(或氧化能力更强)的分子,就像是高处的水向低处流淌。借助这种潜力差,电子流动所携带的能量被用于驱动诸如合成ATP、维持离子梯度等重要生物过程。
在不断发展的生命体系中,呼吸链成为最重要和高效的氧化还原反应平台。NADH与FADH₂称为“电子搬运工”,携带着从食物分子获来的高能电子,逐步“递送”给氧气。整个反应可简化为:
NADH + H⁺ + ½O₂ → NAD⁺ + H₂O + 能量
这里释放出来的绝大部分能量被细胞用于合成ATP分子。ATP被称为“能量货币”,是细胞所有活跃过程的直接能源。
电化学电势的基础理论
电势差的产生机制
要弄懂电势差的本质,我们可以做个日常的类比:比如西湖两侧水位不同时,水会从高处流向低处。如果我们用水坝隔开湖的两边,提升一侧的水位,水位差(势能差)就会使水自动流动。同理,生物膜两侧的离子分布差异也能让电流产生。
生物体内每个细胞都被膜包围,这层细胞膜如同“堤坝”,将细胞内外隔开。由于Na⁺、K⁺、Cl⁻等离子在膜两侧分布极不均匀,导致膜外与膜内之间自然就存在电势差,也就是所谓的膜电位。这一电势差对于神经、肌肉等细胞的正常工作至关重要。
标准电极电势
电子如何在分子间“流转”?不同分子对电子的“渴望”不同。科学家为此建立了“标准电极电势”这一衡量尺度。想象这是衡量谁更想抓住电子的排行榜——电极电势越高,分子越想“抓住”电子(更容易被还原);电极电势越低,分子越容易“放手”电子(更容易被氧化)。
这份表格直观地揭示了氧气在呼吸链中“最终收获电子”的本源——它是电子亲和力排名第一的分子。这也决定了其在生物能源转化链条上的核心地位。
自由能与电势的关系
电化学反应的自由能与电势差紧密相连。它们的关系可用著名的公式表示:
解释如下:
- ΔG:反应的自由能变化
- n:反应中转移电子的数目
- F:法拉第常数(96,485 C/mol,代表每摩尔电子携带的电量)
- ΔE:反应的电势差
这个公式阐明了一条根本规律——电势差越大,反应能“收获”的自由能越多。想象一下水库的水位差,水位越高,水流能驱动的发电机就越有力。在细胞中,正是这种电势差推动了无数生命活动。
能斯特方程与浓度依赖性
浓度对电势的影响
真实的生物环境里,电极电势不仅仅受物种影响,更极度敏感于溶液中特定化学物的浓度变化。德国化学家能斯特(Nernst)在19世纪末发现了这种依赖性,提出了“Nernst方程”——它成了生理解剖离子平衡、电压等难题的钥匙。
为更容易理解,可用泡茶作比:将热水冲进茶杯,茶叶养分从高浓度(茶叶中)扩散进稀薄的水中直至平衡。在生物细胞内外,不同离子的浓度差驱使离子跨膜流动,并在此过程中“制造”电势。
Nernst方程的数学表达
Nernst方程描述了反应电势如何精细地受控于反应物与产物的浓度。方程形式如下:
E = E° - (RT/nF) × ln([还原态]/[氧化态])
通常在生理温度下(25°C),可以简化为:
E = E° - (0.059V/n) × log([还原态]/[氧化态])
含义说明:
- E:实际的电极电势
- E°:该反应的标准电极电势
- R:气体常数
- T:绝对温度(开尔文,K)
- n:电子转移数
- F:法拉第常数
Nernst方程是将动力学和热力学融为一体的少数美妙公式之一:它让我们可以根据不同离子的浓度推算出膜电势的数值,这正是神经生理学研究不可或缺的核心工具。
实际应用示例
为了更具体,我们利用Nernst方程做一道钾离子的计算题。正常人体细胞内钾离子的浓度为140 mM,细胞外约为5 mM:
对钾离子的半反应:K⁺ + e⁻ ⇌ K
Nernst方程有:
E_K = E°_K - (0.059V/1) × log([K⁺]_内/[K⁺]_外) E_K = -2.92V - 0.059V × log(140/5) E_K = -2.92V - 0.059V × 1.45 E_K = -2.92V - 0.086V = -3.01V
但在膜电势的生理计算中,更常用下述变形,把重点放在内外K⁺浓度:
V_K = -(RT/F) × ln([K⁺]_外/[K⁺]_内) V_K = -25.7mV × ln(5/140) = -25.7mV × (-3.33) = +86mV
也就是说,正是因为细胞内外存在剧烈的钾离子浓度梯度,推动着钾离子“乐意”外流,而这一自然驱动就是维持静息膜电势的主体力量。
图中可见,Nernst方程揭示了膜电位与浓度对数比之间成线性关系。浓度大幅变化时,电位值也随之变动,但变动幅度远小于线性关系,这种适度的“阻尼”使生物体有极强的稳态调节能力,不会因为短暂的环境波动就失控。
生物系统中的应用
Nernst方程不仅是科学家的理论工具,更是理解神经细胞电活动、肌肉兴奋等生命现象的基石。细胞膜的静息电位(ex. -70mV)实际上是由多种主要离子的平衡电势复合形成的,而其中“主导者”常常是钾离子。
下面这个表格总结了常见重要离子的分布特点和各自的Nernst电势:
从表中可知,因为钾离子的浓度梯度最大,所以它的化学驱动力也最大——倾向于外流。而钠和钙等离子的外部浓度远大于内部,呈强烈的内流驱动力。细胞膜的整体电位正是这些“方向相反”的驱动力综合后的结果。
这种多离子协同调节使得生物电信号既有稳定性又有灵活性,为调节任何复杂的生命行为(如神经冲动、肌肉运动等)提供了基础保障,从而使高级生命活动成为可能。
离子载体与主动运输
细胞的生命活动离不开膜两侧离子浓度的高度不均,而这种不均恰恰依赖于多种载体分子的“辛勤劳动”。离子载体通过主动或被动机制调控着细胞的内外环境,是生物膜电调控和信号传递的分子基础。
钠钾泵
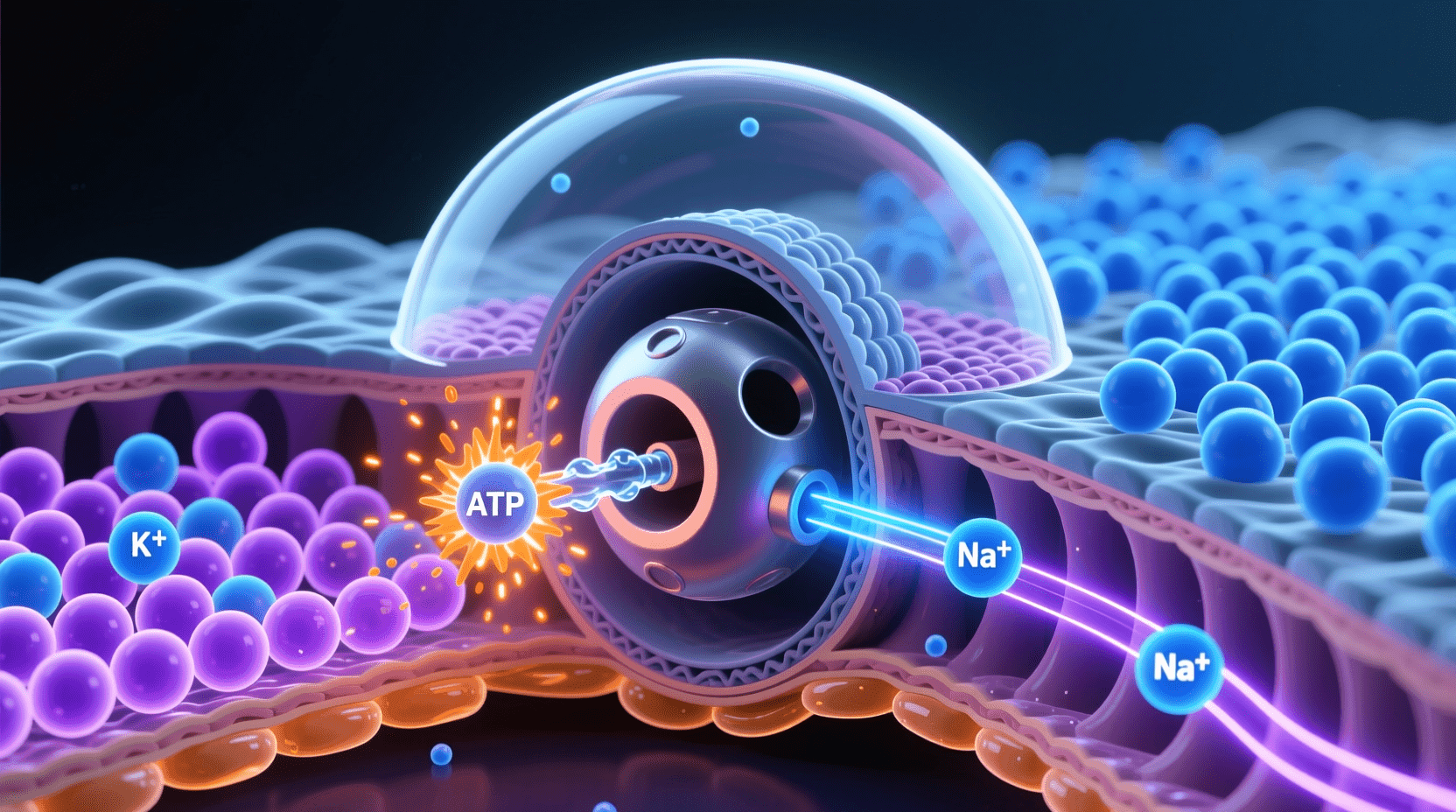
如果将细胞膜比作一道守护城池的高墙,钠钾泵就是这道“城墙”上最尽忠职守的“守门人”。它持续、高效地运作,不断消耗能源(ATP)来维持细胞内部高钾、低钠和外部高钠、低钾的状态。这种分布是维持膜电位、渗透压稳态和细胞自身体积必不可少的根本。钠钾泵的重要性可以用一个统计数据来直观感受:在哺乳动物神经元等高能量代谢的细胞内,钠钾泵消耗的ATP甚至可以占到总能耗的70%以上(在基础状态下约25-40%)。
钠钾泵的本质是一种P型 ATP酶,具有极高的选择性。它每完成一个工作循环,将3个钠离子从胞内泵出、2个钾离子从胞外泵入——整个过程必须消耗一个ATP分子提供能量。这不仅建立了两个离子的浓度梯度,也为细胞膜内外形成“极性”奠定基础。
钠钾泵的作用远超维持离子分布,它还间接影响着细胞渗透压和体积,防止细胞因渗透作用而膨胀破裂。此外,正是因为细胞外钠浓度的持续高企,才为许多二级主动转运(如葡萄糖、氨基酸等的协同转运)提供了动力来源。
钠钾泵的工作机制
钠钾泵的机械运作堪比一台复杂、精密却极高效的小型“分子马达”,其功能涉及一系列时序精准的构象变化。整个循环可分为以下几步:
其核心巧妙之处在于,泵蛋白在E1与E2两种构象间切换,各自对钠和钾离子展现出不同亲和力。ATP的水解和泵自身的磷酸化/去磷酸化转换驱动着整个运输方向的“单向阀门”机制,从而实现对不同离子的定向转运。
钠钾泵的运输有“致电性”特点。由于每轮动作净转移1个正电荷到胞外,它直接对静息膜电位产生贡献,约为-10到-15mV。没有这个泵,神经信号的维持与更新都将成为泡影。
当神经细胞频繁放电时,泵的工作负担加重,其在能量代谢和信号恢复中的作用尤为关键——钠钾泵能够帮助神经元在“超极化”后迅速恢复静息电位,准备迎接下一轮信息输入。
离子通道的选择性机制
若说钠钾泵是“主动守卫”,那么离子通道称得上是“智能大门”。这些通道允许特定离子以极高速度(接近1亿个离子/秒)通过细胞膜,实现被动扩散,不额外消耗ATP,却对选择性极其苛刻。
离子通道的“择优通行”基础可以归纳为:
尺寸选择性: 通道孔径严格匹配离子的半径。例如钾离子通道孔径约2.8埃,几乎完全契合脱水状态的K⁺,而阻挡较小但水化更牢的Na⁺。
电荷选择性: 蛋白通道内衬的氨基酸残基(如羧基、氨基)带电性决定了通道对阳离子或阴离子的亲和力。例如,钾通道孔径内壁布满负电荷基团,专为阳离子量身定做。
水化能选择性: 离子在水中带有水化壳,通过通道前必须“脱衣”——即脱去紧密结合的水分子。合适的氨基酸排列能模拟水分子的配位结构,有效稳定裸离子,为选择性提供更高级的保障。
此外,部分通道还具备“门控”功能,根据不同刺激(电压、配体、机械力等)实现时空上的限流。
电压门控通道的分子开关
电压门控通道是神经电信号“开关”的本体。它们能像“电子门锁”那样实时感知膜两侧电压变化,迅速决策放行与否,是动作电位和信号传导的分子基础。
以电压门控钠通道为例,其结构与运行可拆解为如下几个关键环节:
电压感受器: S4螺旋中的正电荷氨基酸(如精氨酸、赖氨酸)犹如“电压侦查兵”,感受膜电场的微小变化。当膜外变得更负,这些正电荷会受到拉力,引发螺旋的空间迁移。
门控机制: 通道具备“激活门”与“失活门”两个关口。激活门对去极化响应极快,允许离子流入;失活门则在延迟后关闭通路,终止离子流动,保证每次动作电位的单向性。
选择性滤器: 通道内的特定氨基酸序列微调空间尺寸、提供恰到好处的化学环境,使得只有钠离子能够高速穿越而钾、钙等被有效阻隔。
这种高度特化的结构,为神经信号的“火山式爆发”铺平了道路。
这个图表揭示了电压门控离子通道的响应特征:它们对膜电势的变化反应呈S形(sigmoid)曲线。钠通道在较负电势(约-60~-40mV)即被迅速激活,迅猛打开——这是动作电位快速上升的关键。相对地,同样的电位下钾通道几乎尚未响应,只有到膜电势进一步去极化时才逐渐开启(延迟激活),负责动作电位的“刹车”与复极。两者时间上的错位恰好为神经冲动单向、高效、快速的传递与恢复提供了分子基础。
综上所述,离子载体与离子通道携手,为细胞电化学稳态、信号起始与高速通讯筑牢“生命之门”。
神经传导的电化学机制
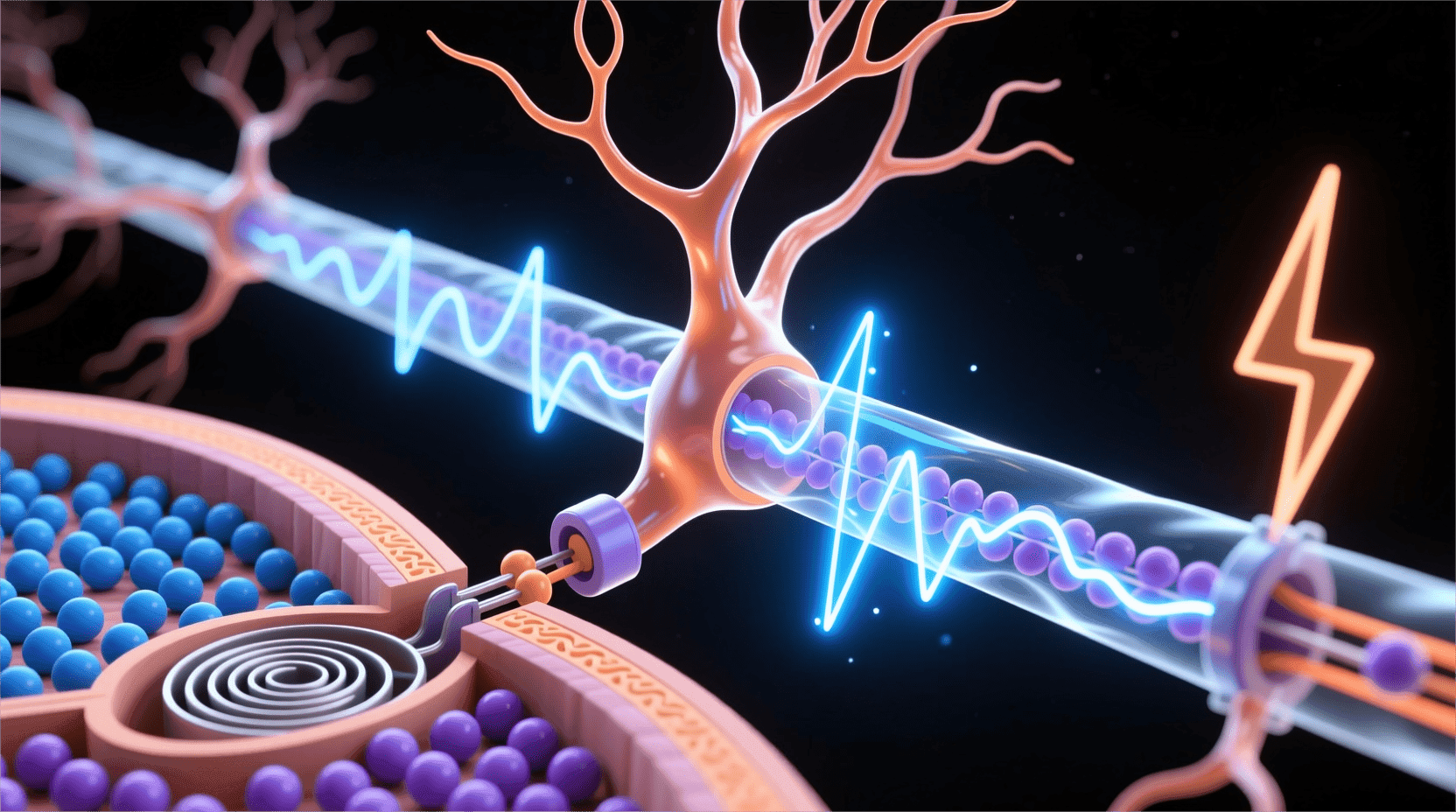
动作电位
动作电位是神经系统中传递信息的核心方式。我们可以将其比作古代烽火台用烟火传递军情,或现代电报用电信号通信。其实,每一个从北京传递到上海的神经信号,背后都是一次沿神经纤维传播的精妙电化学“浪潮”。这个浪潮不是机械推动,而是无数离子的精准协作。
如果要用形象的比喻,动作电位的传播就像多米诺骨牌的连锁倒塌:当首块骨牌倒下后,会引发后续骨牌接连倒下,形成波动;但在神经元中,这个波动是电流和离子的流动在细胞膜上传递。不同于单向倒塌的多米诺骨牌,神经元有机制防止信号反向传播,确保信号的高效单向传输。
静息电位的维持
当神经元处于静息状态时,其膜内外存在大约-70mV的稳定电位差。这一电位的维持是生物体内部复杂精细的电化学均衡的成果,涉及多个因素的共同作用:
1. 钠钾泵的贡献:
钠钾泵(Na⁺/K⁺-ATPase)在神经元膜上持续工作。每次泵动消耗一个ATP分子,便将3个Na⁺泵出胞外,2个K⁺泵入胞内。这种主动转运每轮都会向细胞外净输出一个正电荷,直接贡献了静息电位中约-10至-15mV。没有钠钾泵,静息电位无法维持,细胞也会丧失兴奋性。
2. 钾离子的漏电流:
细胞膜对不同离子的通透性不同,对K⁺的通透性相对较高。K⁺因浓度梯度向胞外“泄漏”,带出正电荷,使胞内变得更为负电。漏流一直持续到电化学平衡时的Nernst电位(理论上约-90mV)。钾离子的流动几乎决定了静息电位的“主旋律”。
3. 钠离子漏电流与大分子阴离子贡献:
尽管膜对Na⁺相对不太通透,仍有微量Na⁺渗入使电位微幅“去极化”。同时,细胞内含有大量带负电的大分子(蛋白质、DNA等),这类不可扩散阴离子进一步加深了膜内的负电环境。
4. 氯离子的分布:
Cl⁻通常随动于膜电位变化,对静息电位贡献较小,但在特定细胞(如小脑某些神经元)中可能会发挥更大作用。
我们可以看到,正是多种离子与蛋白质之间的协作,造就了静息电位的精确稳定。
动作电位的产生过程
动作电位的出现,就像一场高度协作的“电化学芭蕾舞”,其过程可划分为以下阶段:
- 阈电位触发
当膜电位由静息(-70mV)升高到阈值(大多为-55mV)时,电压门控钠通道(Nav)大量开放,这就像系统达到了“点火阈”,一场电化学风暴即将爆发。
- 快速去极化
随钠通道开放,外界Na⁺顺着浓度和电势梯度急速内流,这导致细胞内短时间内正电快速堆积,膜电位急遽上升,能冲到+40mV乃至更高。这一相位仅持续约1毫秒,决定了神经信号的快速性。
- 钠通道失活——安全机制
当去极化达到高峰后,钠通道开启了“自闭锁”,防止连续无序放电。与此同时,电压门控钾通道(Kv)逐步开放。
- 复极化
开放的钾通道让K⁺迅速流出,带出正电,使膜电位回降并返回负值。该阶段动作电位形态迅速从高点跌落回静息甚至更低。
- 超极化与复原
钾通道关闭滞后,使得细胞膜电位短暂下滑低于静息电位(超过-70mV,临时“低谷”称为超极化)。在这一阶段,神经元进入“难以再激”状态,防止信号反向传播。随后多种泵和通道协调作用,膜电位最终恢复休息水平。
- 绝对与相对不应期 动作电位的失活和超极化阶段,神经元对新刺激的反应能力下降,有助于神经信号按单向推进、不会“回头”或叠加异常信号。
- 亚阈值刺激 如果刺激不足以使膜电位达到阈值,不会触发动作电位,体现“全或无”规律。
动作电位的传播机制
动作电位一旦在一个部位产生,便可通过“局部电路电流”波及邻近部位,激发新的动作电位。因此,神经冲动能沿轴突整体推进,如火车车厢彼此牵引。当某一区域膜去极化时,局部形成正向电流,这些离子向前流动,促使下一区域膜电位到达阈值,触发新的动作电位,周而复始,神经冲动得以快速远距离传递。
有髓神经纤维的跳跃式传导
在有髓鞘的神经纤维(如脊髓运动神经)中,髓鞘包裹绝缘,使动作电位只在“朗飞结”(Nodes of Ranvier,无髓间隙)发生。信号可由一个结跳到下一个,速度极大提升,如同高速公路上的汽车可在收费站间疾驶。无髓纤维则只能以较慢的连续“蔓延式”传播。
影响传导速度的主要因素
- 神经纤维直径:越粗,内部电阻越低,电流传播越快。自然界中大多数快速反应动物(如乌贼巨型轴突)拥有粗大的神经纤维。
- 是否有髓鞘:有髓结构可大幅度提升信号速度,并节省代价,减少离子流耗能。
例如:我们摸到烫物时,首先是Aδ纤维带来的“快痛”,后续的C纤维则产生“慢痛”。而动作指令则通过粗大的Aα纤维迅速到达肌肉。
电缆方程与信号衰减
在神经纤维,电信号的衰减和传播符合物理学中的“电缆方程”。可类比为水管中的水流遇到阻力而减速、减弱。电缆方程刻画了膜电位随时间、距离变化的规律:
其中:
- τ为膜时间常数(τ=Rm×Cm,Rm为膜电阻,Cm为膜电容),决定响应速度;
- λ为长度常数(λ=√(rm/ri),rm为单位长度膜电阻,ri为单位长度轴浆电阻),决定信号可“跑”多远才会衰减至剩1/e;
- V为膜电位;
- x为空间距离。
λ(长度常数)越大,信号衰减越慢、传播越远。 这也解释了为什么粗大、有髓的神经纤维能高效远距离传递信号——大直径降低ri,髓鞘提高rm,从而共同增大λ。
增加纤维直径可降低轴浆阻力,髓鞘包裹则提升膜电阻,二者均有利于提高效率和速度。这也是神经系统“进化上的权衡”:速度与能耗之间的最佳折衷。
电化学能在生物系统中的意义
能量储存与转换
电化学梯度是生物体能量储存与利用的基础,就像细胞“充电电池”。以线粒体为例,它通过呼吸链活动持续将质子泵至膜外,形成高浓度差,带来高达200mV的跨膜电压。这一巨大电势驱动ATP合酶“转动”,将ADP和Pi合成高能ATP,支持生命各种耗能活动。质子梯度的能量本质上是一种可被迅速调用的“电化学货币”。
植物的叶绿体也采用相似机制,通过建立跨膜质子梯度来合成ATP。其他如细菌鞭毛旋转、主动运输等,皆依赖电化学梯度完成能量耦合与转换。
信号传递与调控
电化学信号不仅造就了神经冲动的高速传递,它同样是细胞内信号转导网络的枢纽。
尤其是钙离子的梯度:胞外Ca²⁺浓度比胞内约高万倍,这一巨大差异使得当钙通道短暂开放时,钙离子能瞬间涌入,启动肌肉收缩、调节基因表达、促进神经递质释放等多种生命反应,起到“信号开关”的作用。
其他如细胞凋亡(钙超载)、胰岛素释放、免疫反应等过程也借助电化学梯度完成微妙调控。
综上,我们可以看到:
- 从分子层面的离子泵与通道,到神经元乃至整个神经网络的信息流动,以及线粒体ATP合成等能量操作,电化学能量都居于生命核心;
- 对电化学机制的深入理解有助于解析多种疾病机理(如癫痫、多发性硬化、肌无力等),也是生物医学和生物工程新疗法的理论基石。
生命活动的本质,某种意义上便是 “有序的电化学交响乐”。