蛋白质结构
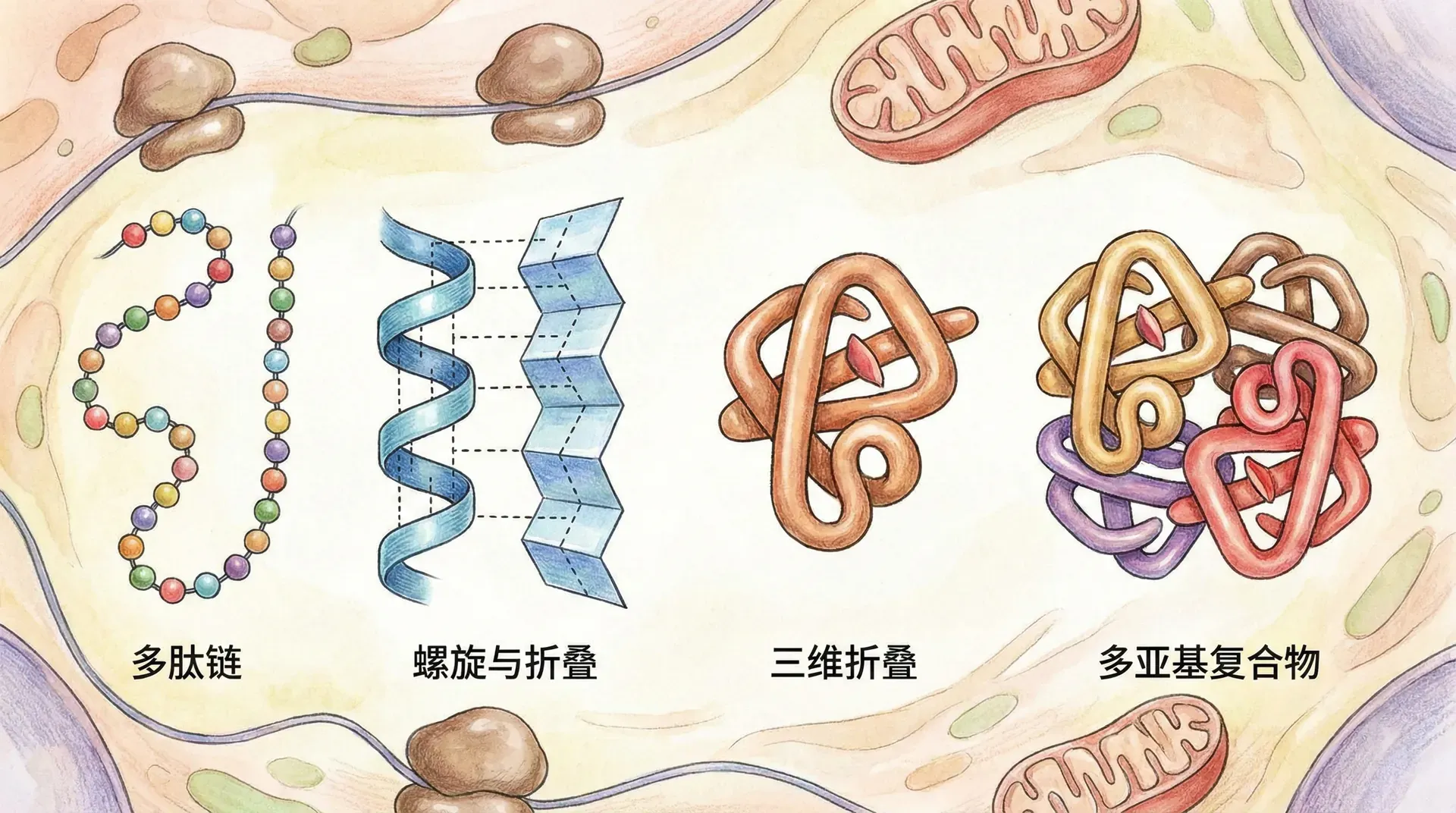
蛋白质是生命活动的主要执行者,无论是在催化机体内复杂生化反应的酶类、支撑细胞框架的结构蛋白,还是运载和传递信号的载体蛋白,均凭借其独特而精确的三维结构,彰显强大功能。蛋白质的这种精妙结构,就如同中国古代能工巧匠制器造物前需精细设计蓝图,将各个部件规范组合,才能最终成器。每一个结构层次都深刻影响着蛋白质的生物学功能和稳定性。
生活中蛋白质结构与功能的关系随处可见。例如,在制作豆腐过程中,蛋白质会因为加入卤水等凝固剂发生空间结构重组,出现凝集沉淀,这是蛋白质结构变化所带来的物理表现;又如蚕丝蛋白,正是由于蛋白质分子有序地折叠形成特殊的结构单元,才能纺成既轻薄又坚韧的丝绸。本章将系统梳理蛋白质从一级结构、二级结构、三级结构到四级结构的完整组织原理,并结合生活实例与科学研究成果,揭示这些生物大分子如何通过空间结构的优化实现复杂生命功能,对理解生命现象打下坚实基础。
蛋白质结构的层次组织
从氨基酸到蛋白质的构建历程
蛋白质分子的结构被分为四个层次:一级结构、二级结构、三级结构和四级结构。每一层次都是对前一层的进一步组织和折叠,每一步的变化都直接影响蛋白质的最终功能。可以将这种“层层递进”理解为中国传统建筑从单块砖瓦、木材,到各部分结构搭建,再最终呈现功能完整的居所。
蛋白质的功能有赖于其精确的三维结构。哪怕仅仅替换一个氨基酸残基,都可能引起蛋白质折叠异常,导致活性丧失甚至疾病的发生,如镰刀型贫血就源自于血红蛋白一级结构的单一突变。“结构决定功能”是蛋白质领域的核心法则。
一级结构由氨基酸的线性排列组成,氨基酸的种类和顺序决定了蛋白质的全部空间折叠信息。1961年,美国科学家克里斯蒂安·安芬森利用核糖核酸酶实验证明:蛋白质在变性后,若恢复适当条件,可完全自发地折叠还原为具有原有活性的天然构象。这一发现奠定了一级结构决定三维结构的理论基础,也是现代分子生物学的重要进展。
值得注意的是,人类基因编码的氨基酸虽只有20种,但通过各种不同的排列组合,能够构建出成千上万种具有不同性质与功能的蛋白质。这种“无限组合,有限元件”的模式,是生物多样性的重要基础。
α螺旋和β折叠
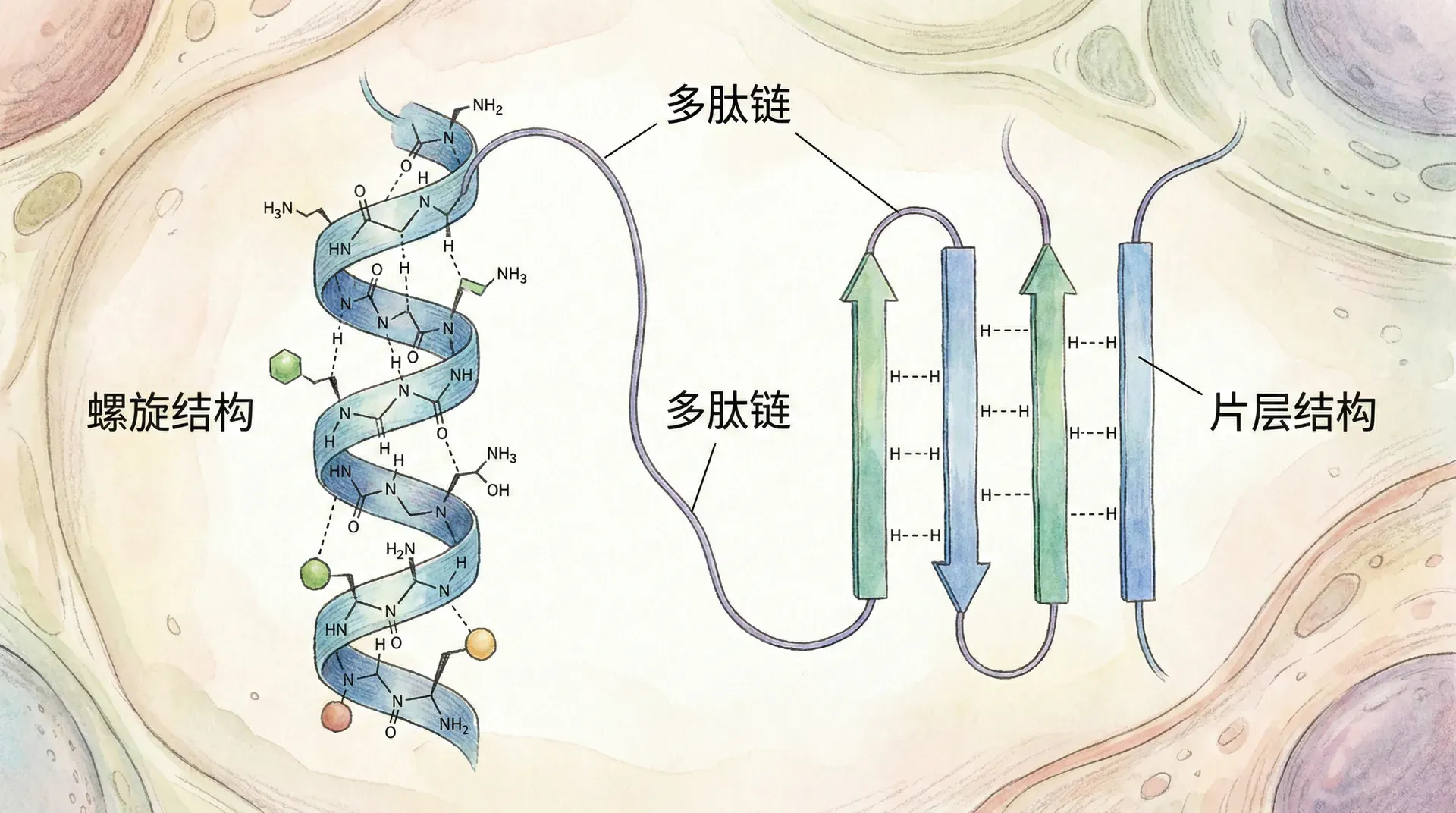
α螺旋的精妙设计
α螺旋是最常见也最经典的二级结构单元之一,在众多蛋白质分子中都能发现它的身影。早在1951年,著名科学家莱纳斯·鲍林(Linus Pauling)分析了肽键的空间构象后,推算出了α螺旋的几何参数,后来通过X射线晶体学实验证实了这一结构。
α螺旋的结构非常有规律:每圈螺旋约包含3.6个氨基酸残基,螺距为5.4埃(Å),每个氨基酸残基沿螺旋轴上升1.5埃。这样的空间排列通过主链羰基氧与下一个第n+4位残基酰胺氢之间的氢键稳定下来,形成紧密的氢键网络。氨基酸侧链则突出于螺旋外部,为蛋白质整体空间布置和功能提供灵活性。
α螺旋可以类比为一根旋转上升的“楼梯”,不断螺旋上升的骨架,使整根肽链稳定紧凑,又不失灵活。在高弹性的角蛋白(如人类毛发、羊毛等)中,正是α螺旋大量存在,使得这些材料既柔韧又抗拉伸。
值得补充的是,有些氨基酸更容易参与形成α螺旋,如丙氨酸、谷氨酸和亮氨酸,而脯氨酸因其特殊的环状结构常作为“螺旋终止子”,断裂α螺旋进程。
β折叠的巧妙排列
β折叠(β-pleated sheet)同样是常见的二级结构,与α螺旋不同,β折叠的肽链几乎完全平展,通过多条链段(β链,β-strand)排列形成片层,这些片层通过主链羰基氧和酰胺氢之间的氢键彼此连接。
β折叠分为平行(parallel)和反平行(antiparallel)两种类型。在反平行β折叠中,氨基和羧基末端指向相反方向,氢键排列更为整齐稳固;平行β折叠则同向,但氢键角度较大、排列稍显“不规则”。
蚕丝蛋白作为β折叠结构的典型代表,在其分子结构中的大面积β片层相互堆叠,从而造就了丝绸的光泽、柔软和极高的拉伸强度。这一分子层面的巧妙结构设计,被中国古代丝绸工艺充分利用,是中国传统科技与生物化学的完美结合。
此外,β折叠还广泛存在于其他生物材料和蛋白质中,如人体的抗体蛋白、角膜蛋白等,也具有重要的生物学功能。
拉氏图
拉氏图(Ramachandran plot)是一种展示蛋白质主链构象空间允许区域的重要工具,由印度生物物理学家拉马钱德兰(G.N. Ramachandran)于20世纪60年代提出。蛋白质主链的两个关键二面角:φ(phi)和ψ(psi),决定了骨架的旋转与空间构象,因为肽键处于平面状,所以这些角的取值范围受到空间位阻的极大限制。
在拉氏图上,α螺旋与β折叠分别占据两个主要允许区域,大部分蛋白质残基会集中分布于这些区域中。甘氨酸(Gly)由于无侧链,空间自由度大,构象范围最广,可见于图中其他分散点;脯氨酸(Pro)则因环结构束缚,主链旋转很小,只能出现在某个狭窄的区间内。
拉氏图不仅是理论计算工具,也是结构生物学中验证三维模型合理性的重要标准。通过分析蛋白质整体和局部二面角分布,科学家可甄别结构模型的真实性和可能存在的异常区域,从而优化蛋白质结构的预测和分析过程。
疏水相互作用
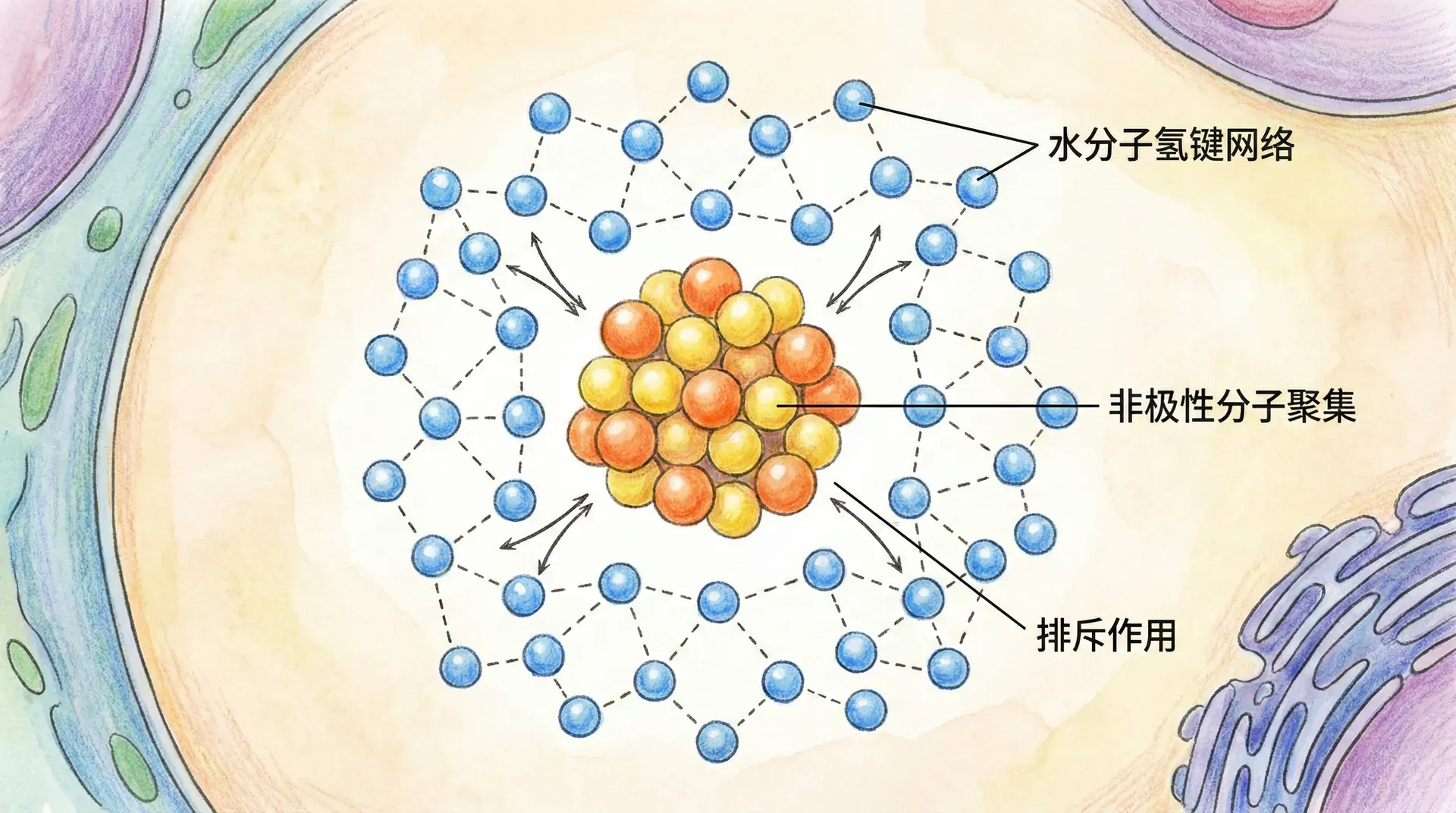
水分子的作用
蛋白质折叠过程中,疏水相互作用起着至关重要的作用。这种作用力的本质是熵效应:当疏水基团聚集时,周围的水分子能够形成更多的氢键,从而增加了系统的熵。水分子的这种组织行为,本质上是避免与疏水基团直接接触,使水分子间的氢键网络更加完善。由此,疏水效应不仅推动了蛋白质三级结构的形成,也是细胞内分子自组装、自我分区现象的重要基础。
疏水核心的形成是蛋白质折叠的主要驱动力。就像油滴在水中会自发聚集一样,蛋白质中的疏水氨基酸残基也会聚集在分子内部,形成疏水核心。
这个过程可以用制作豆腐的例子来理解。当大豆蛋白遇到凝固剂时,蛋白质分子重新排列,疏水部分相互聚集,亲水部分朝向外部,最终形成稳定的凝胶结构。类似地,牛奶制成乳酪、蛋白质在凝胶和泡沫中的自组装,背后也都蕴含着疏水作用。实际上,生物膜和细胞器等更高级的结构层次中,疏水效应依然在维持整体结构稳定性和分子专一性识别中扮演着核心角色。
疏水氨基酸主要包括缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸、丙氨酸等。这些氨基酸在蛋白质分子中往往分布在内部,远离水环境,而亲水氨基酸则多位于分子表面与水接触。
蛋白质折叠的能量景观
蛋白质折叠是一个高度复杂和动态的过程,可以用“能量景观”理论来描述。想象蛋白质主链在高维空间内经历无数可能的卷曲和伸展,每种构象都对应着不同的能量状态。蛋白质在折叠过程中不断尝试和探索,最终趋向于能量最低的稳定构象。
所谓“漏斗状”的能量景观指的是,从一大堆无规则卷曲(高能量/高可能态),蛋白质逐步滑向天然态(全局最小自由能)。有趣的是,在折叠过程中,蛋白质还可能陷入“局部能量最低陷阱”——错误的、非功能性的折叠,形成聚集体或异常结构。例如,阿尔茨海默病、朊病毒病等神经退行性疾病都与蛋白质错误折叠相关。
除了疏水作用,氢键、静电作用、范德华力等共同参与了能量景观的构架。研究蛋白质折叠的能量景观,不仅是理解生命分子自组织的基础,也是药物设计和人类疾病防治的重要方向。
在细胞拥挤环境和复杂分子背景下,如果分子折叠不完全、聚集或者被环境干扰,往往产生有毒寡聚体或沉淀,这也是如巴金森病、ALS等疾病分子病理机制的关键所在。目前,利用分子动力学模拟、单分子荧光等高分辨率技术,科学家们正逐步揭开能量景观的动态全貌。
分子伴侣的辅助作用
在细胞内的拥挤环境中,蛋白质折叠面临着巨大挑战。分子伴侣系统就如同熟练的工匠师傅,帮助蛋白质获得正确的结构。没有这些“辅助折叠工具”,许多大分子将在合成完成后立刻聚集或错误折叠,无法行使其正常生物学功能。
热休克蛋白(Hsp)家族是最重要的分子伴侣之一。Hsp70通过结合新生肽链的疏水区域,防止不正确的相互作用;而GroEL/GroES系统则提供了一个隔离“微囊”折叠环境,让蛋白质在没有外界干扰的条件下正确折叠。更复杂的伴侣如Hsp90、Hsp60均有各自的折叠机制和能量依赖性。
分子伴侣在蛋白质生命周期的多个阶段都发挥着作用:不仅指导新生多肽链的折叠,还能修复、拆解已经聚集或变性的蛋白质,有的甚至直接参与降解错误蛋白,防止细胞受到损害。分子伴侣的活性受热休克、应激反应等多种环境刺激的调控,是细胞蛋白质稳态维护的守护者。
膜蛋白
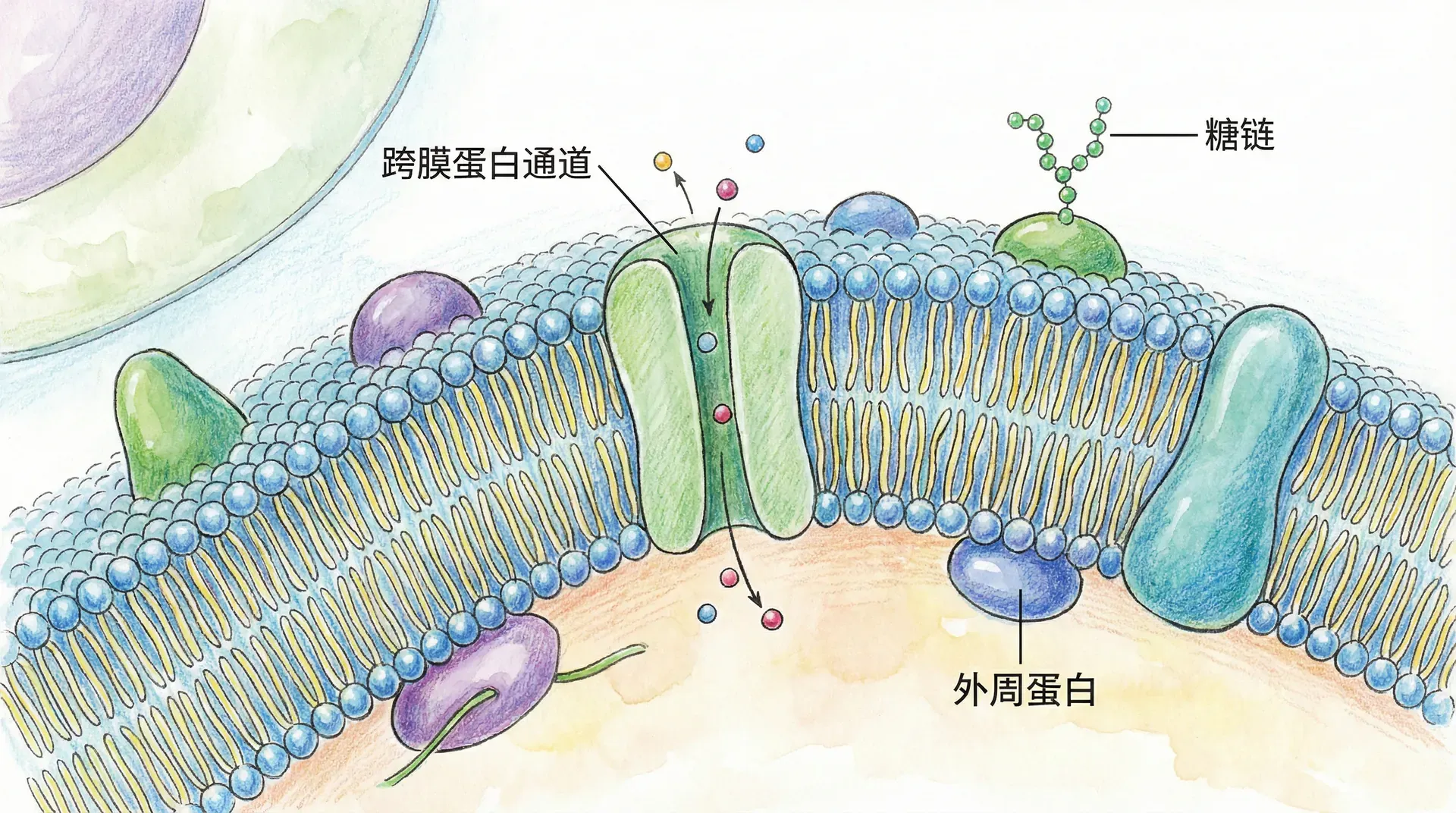
脂质双分子层中的蛋白质
膜蛋白面临着独特的结构挑战:它们必须在疏水的脂质环境中保持稳定,同时还要执行跨膜运输、信号传导等功能。这些蛋白质采用了与水溶性蛋白质截然不同的结构策略。例如,细胞膜由疏水的脂双分子层组成,普通蛋白质多数处于水环境,而膜蛋白则长时间处于脂质环境,稳定性和功能依赖于其特殊的结构设计。
膜蛋白约占人体蛋白质总量的三分之一,却承担着多种关键生理功能,如细胞通讯、能量转换、环境感知等。许多药物靶点正是不同类型的膜蛋白。
常见的膜蛋白结构域包括跨膜螺旋α-helix、β-桶domain、蜗牛状环以及信号肽等。许多家族在进化过程中,通过不同的结构组合,演化出了独特的功能。例如,G蛋白偶联受体(GPCR)家族有七段跨膜α螺旋,是药物研发中的热点。
跨膜螺旋的设计原理
跨膜螺旋通常由疏水性氨基酸组成,能够与脂质双分子层的疏水尾部相互作用。这些螺旋的长度通常与膜的厚度相匹配,大约为20-25个氨基酸残基。这一设计不仅决定了蛋白质能否正确插入且稳定于膜中,也决定了蛋白质在膜中的分布、运动和相互作用能力。
例如某些跨膜螺旋会形成离子通道或者G蛋白受体的信号通路,部分可发生构象变化,实现物质转运或信号传递。Gly、Ala等小分子氨基酸有助于螺旋的紧密贴合,Pro等则有助于产生弯曲和结构多样性。
跨膜螺旋就像是穿越细胞膜的隧道,它们必须具有合适的疏水性质才能稳定存在于脂质环境中。同时,螺旋的两端通常含有一些极性氨基酸,用于与膜的极性头基区域相互作用。
多个α螺旋可以在膜内聚合形成多亚基通道或信号蛋白,通过螺旋间的疏水和范德华作用进一步增强整体稳定性。例如光合作用相关蛋白复合体、细菌感受器等都利用了类似的结构原理。
β桶孔道的精妙构造
β桶孔道是另一类重要的膜蛋白结构,主要存在于细菌的外膜中。这些蛋白质由多条反平行的β链组成筒状结构,桶壁疏水,内腔亲水,形成了选择性的通道。这种桶状结构可以隔绝膜的疏水环境,将亲水的小分子(如离子、葡萄糖等)安全高效地从外界转运进细胞内部。
大肠杆菌的OmpF孔蛋白是β桶膜蛋白的典型代表,它由16条β链组成,形成一个允许小分子通过的通道。这种结构的巧妙之处在于,它能够在保持膜完整性的同时,允许必需物质的通过。许多细菌抗药性相关的蛋白也属于β桶蛋白,通过调节通道直径和化学性质,选择性拒绝某些抗生素分子进入。
此外,β桶结构的进化和多样性极为丰富。一些真核生物的线粒体、叶绿体外膜也存在类似的β桶蛋白,不仅维持膜稳定,还参与分子识别和信号调控。
α螺旋膜蛋白通常具有较高的疏水性指数和变动范围较大的跨膜区域数量,如G蛋白偶联受体可达12个跨膜区域;β桶膜蛋白的疏水性指数略低,但跨膜区域数量往往更多,OmpF孔蛋白作为例子有16条β链。
随着冷冻电镜(Cryo-EM)、单分子追踪、电生理等新技术的发展,科学家在分子层面揭示了更多膜蛋白的复杂动态。当前超过一半的药物靶点为膜蛋白,针对跨膜结构的理性设计与功能解析,正成为结构生物学与药物化学的研究热点。
膜蛋白结构的多样性、功能的复杂性,使其成为生命科学中最具挑战性的研究对象之一。从离子通道的快速开关反应,到信号受体的协同调节,膜蛋白的结构原理和工作机制,正深刻影响着我们对生命本质的认识以及精准医学的发展方向。
蛋白质结构与功能的协同统一
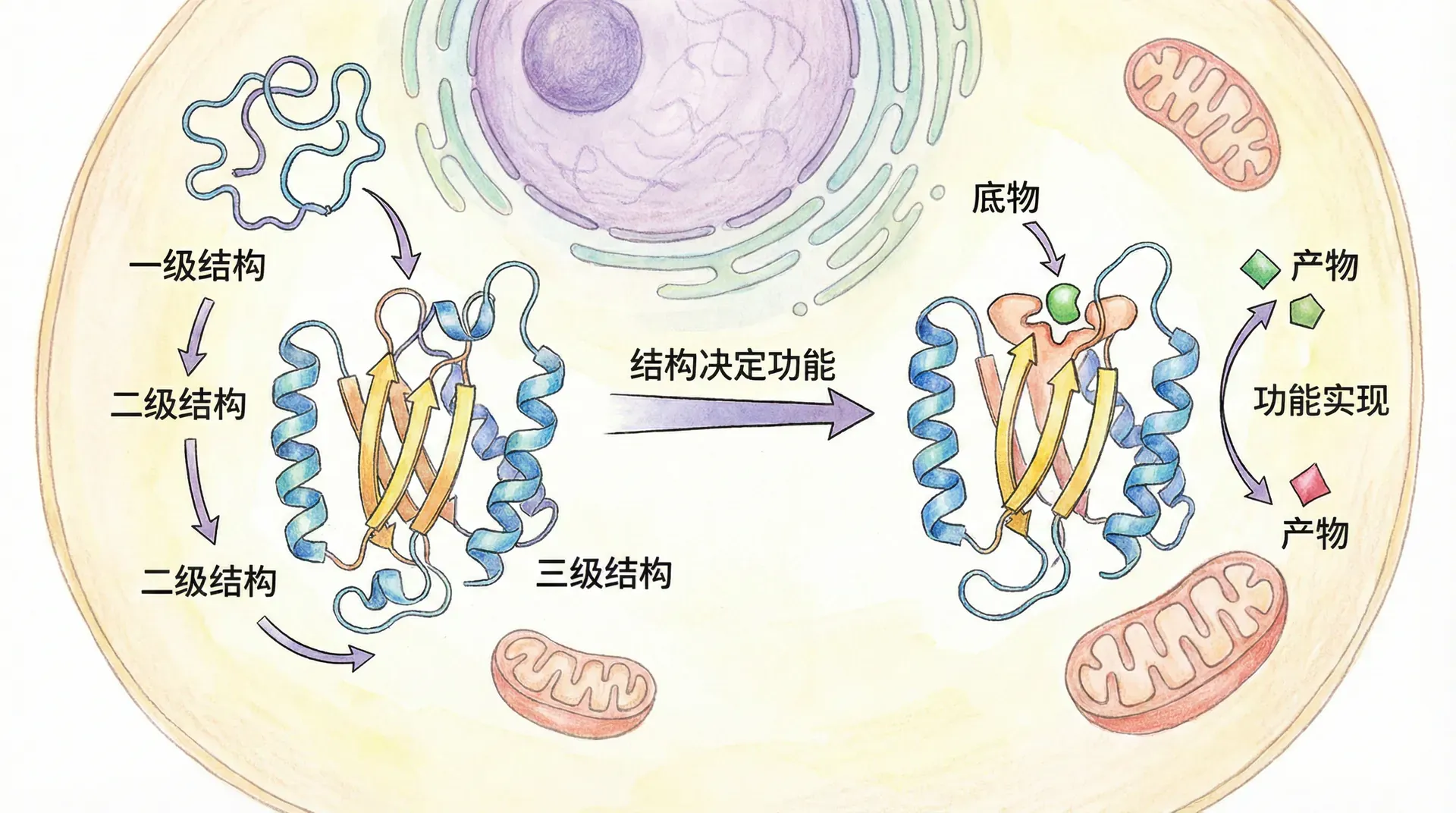
蛋白质是生命活动的基础,其结构与功能密不可分。三维结构不仅决定稳定性,也决定了与其他分子的作用方式。无论是膜上的离子泵、催化反应的酶,还是可调控的多亚基蛋白,结构和功能始终协同演化、相互依存。
以钠钾泵为例,其通过水解ATP,每次将三个Na+移出、两个K+移入,建立细胞内外离子梯度。这一过程依赖于α亚基的多个跨膜螺旋(形成通道)和β亚基的定位作用。泵的周期性构象变化实现了选择性离子运输,并维持细胞极化状态。同类的Ca2+泵、H+泵广泛存在于生物体内,参与离子稳态、神经信号和能量代谢等多种生理过程。例如,质子泵在胃酸产生、Ca2+泵则精准调控细胞内钙浓度。
酶的活性位点与高效催化
酶用其独特的空间折叠,将底物引入活性位点进行催化。不同于氨基酸线性序列,活性位点通常由分布于蛋白不同部位的残基共同协作,创造有利于反应发生的微环境。以胃蛋白酶为代表,关键Asp残基通过氢键网络协同发挥作用。酶的极高催化效率,源于对过渡态的精准识别和稳定。此类微环境常需金属离子或辅酶辅佐,如NAD+、FAD等。下表简述调控类型与意义:
酶能将生化反应加速至原始水平的106~1017倍,关键在于活性位点精准稳定过渡态,显著降低反应活化能,使反应在温和条件下高效进行。
变构调节与生物灵活性
变构调节使蛋白能通过非活性位点的分子结合产生全局构象改变,从而精准响应环境或信号。例如血红蛋白,氧气结合后分子整体转为高亲和形态,大大提升携氧能力。这类协同/变构效应常见于信号传递、代谢通路,显著增强蛋白的调控灵活性。
结构指导下的蛋白质工程
现代蛋白质工程整合结构分析和理性设计,推动了基础科学和产业创新。通过定点突变、结构域重组等策略,可精准调整蛋白功能。例如工业洗涤酶改造可提升耐高温高碱性的能力、抗体结构优化提升药物效果,人工酶则拓展了全新催化领域。在中国,蚕丝蛋白经过基因和结构改造,诞生了高强高韧的新材料;水处理和环境治理等领域,结构优化后的酶显著提高了降解效率。
蛋白质结构的精妙与功能的多样,体现了自然界分子级别的“工程艺术”。对这些结构原理的理解,不仅加深了对生命本质的认知,也为生物材料、催化体系和药物创新提供了坚实基础。
综上,蛋白质的各级结构折叠、关键的分子间作用力与调控机制(如膜蛋白、离子泵、酶活性中心、变构调节等),共同成就了蛋白质功能的复杂多样性和高度协调。这些知识为进一步研究蛋白质的变异、调控、分子机制等奠定了基础。下一章我们将深入探讨蛋白质在进化中的变异规律,以及这些变异如何影响结构与功能,推动生命复杂性的演化。