能量与分子间作用力
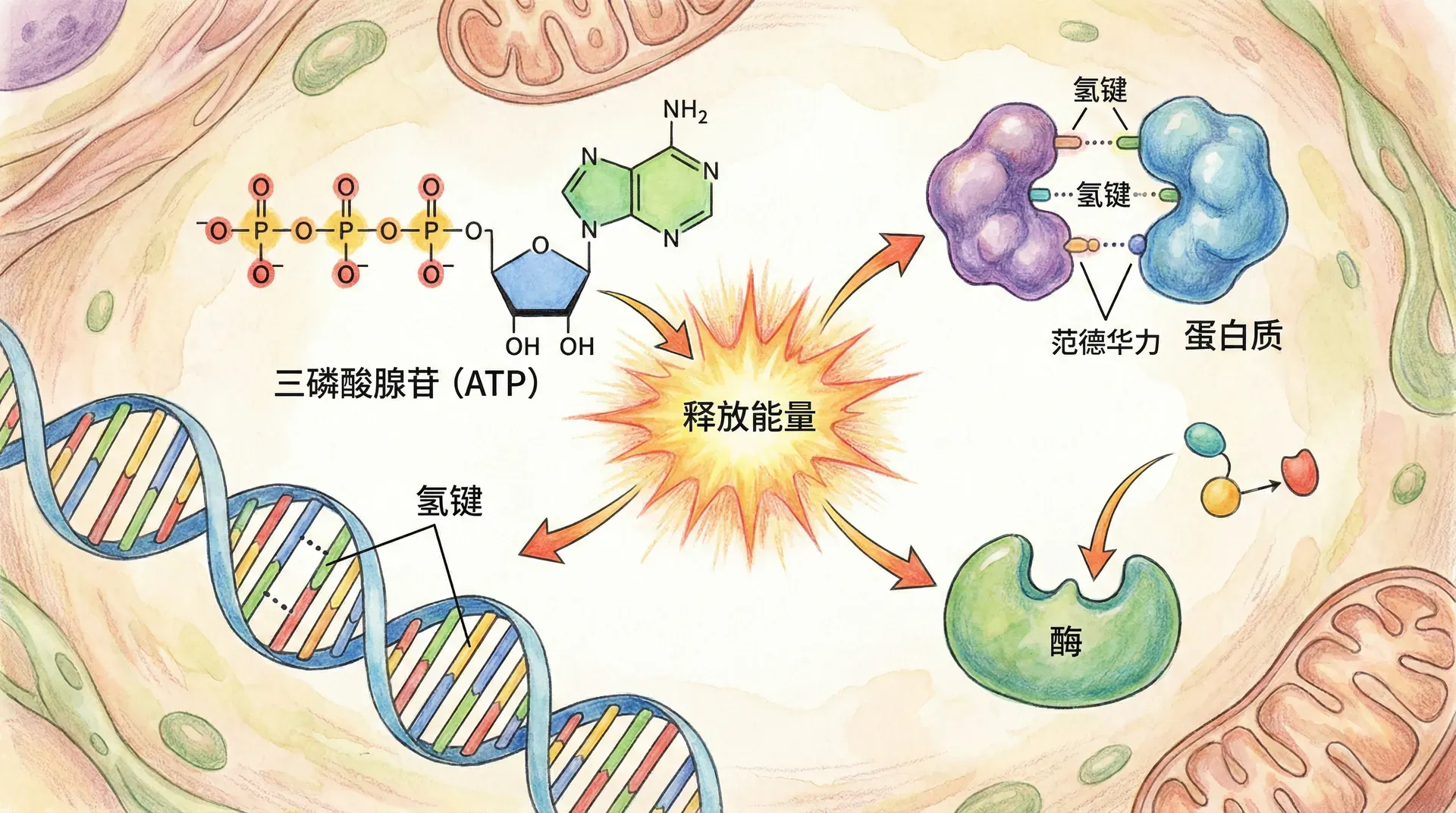
生物系统中的每一个过程——无论是蛋白质的折叠与解折,还是细胞能量的产生与转换,亦或是酶催化下的高效化学反应——都始终严密地遵循着能量守恒的根本定律。生命的每一次跃动和变化,背后都隐藏着复杂的分子结构调控、分子间的精巧作用力,以及由此引发的能量流动和转换。正是这些能量变化和分子力学机制,为生命体的有序性、自组织性和精密调控提供了坚实的物理化学基础。
理解这些分子层面的原理并不只是理论意义上的工作。唯有深入洞察微观世界中分子如何彼此作用、能量如何流转,我们才能真正把握生命活动的本质规律,为医学创新、生物工程和神奇的生命现象解析提供坚强支撑。
接下来,我们将以热力学第一定律为起点,系统剖析能量守恒在分子层次的表现,并逐步探究蛋白质、核酸等生物大分子中的分子间作用力及其能量基础,从而理解这些核心原理如何影响和塑造多彩的生命现象。
热力学第一定律与生物能量学
能量守恒定律
热力学第一定律指出:能量既不会凭空产生,也不会凭空消失,而只是在不同形式之间不断转化。在生物系统中,这一能量守恒的原则表现得尤为重要。例如,光合作用能够将太阳能转换为生物可利用的化学能,细胞呼吸则将有机分子的化学能释放出来,部分用于驱动生命活动,其余则以热能形式散失。
热力学第一定律的数学表达:,
其中表示内能变化,为系统吸收的热量,是系统对外界所做的功。
当葡萄糖分子在细胞内被氧化时,化学键中储存的化学能被逐步释放。部分能量以ATP的形式被捕获,供细胞进行生物合成、主动运输等生命活动,另一部分则转化为热量,维持细胞及生物体的温度恒定。这个看似简单的反应,其实是能量守恒定律的生动体现。
在更微观的层面,每当一个化学键断裂或形成时,系统的能量状态都会发生变化。例如,蛋白质在水溶液中自发折叠成天然态时,分子内部通过形成氢键、疏水相互作用和范德华力等,使系统总能量降低。这些能量变化不仅决定了蛋白质的结构稳定性,也影响其生物学功能。而在生物催化过程中,酶通过降低反应活化能,实现能量从底物到产物的高效转移。细胞中的能量流动与转换,正是所有物质代谢和信号传递过程的能量基础。
焓变的概念与意义
焓(H)是一个重要的热力学状态函数,定义为,其中为系统的内能,为压强,为体积。对于大多数生物过程而言,恒温恒压是常见条件,这时系统的焓变()就等同于与环境交换的热量。理解焓的变动对于分析生物化学反应、蛋白质折叠和分子识别过程等极为关键。
在实验中,研究人员可以通过量热法直接测定生物分子的焓变。例如,蛋白质的变性常常表现为吸热反应——破坏蛋白质内部氢键、疏水相互作用等稳定因素,需要不断输入能量;而蛋白质自发折叠回天然构象时,则体现为放热反应,表明折叠态的能量低于展开态。这些能量差异直接决定了分子是否能够维持其天然状态。
此外,焓的变化还与蛋白质在不同环境中的稳定性密切相关。例如,盐浓度或pH的改变可能影响分子间的静电相互作用,从而影响焓变,并导致蛋白质折叠/解折叠的平衡发生改变。在分子识别和配体结合中,焓变也常常作为判断结合强度和专一性的热力学指标。
从上面的图表可以看到,蛋白质从高能量的无序展开态,经过能量逐步降低的过渡态,最终趋向于低能量的有序折叠状态。整个过程释放能量(),显示为放热反应,这也从热力学层面解释了为什么蛋白质有自发折叠、维持其特定三维结构的趋势。实际上,生物体内许多分子自组装和有序构建的本质正是能量最小化原理的体现。
除了蛋白质折叠,很多生命活动都离不开能量守恒和焓变的基本原理。例如,DNA的双链解旋和复性、脂质双层的形成与破坏,都伴随着系统能量的输入或释放。理解这些能量变化规律,为我们认识生命过程背后的物理化学基础提供了坚实的理论支撑。
热容量与分子运动
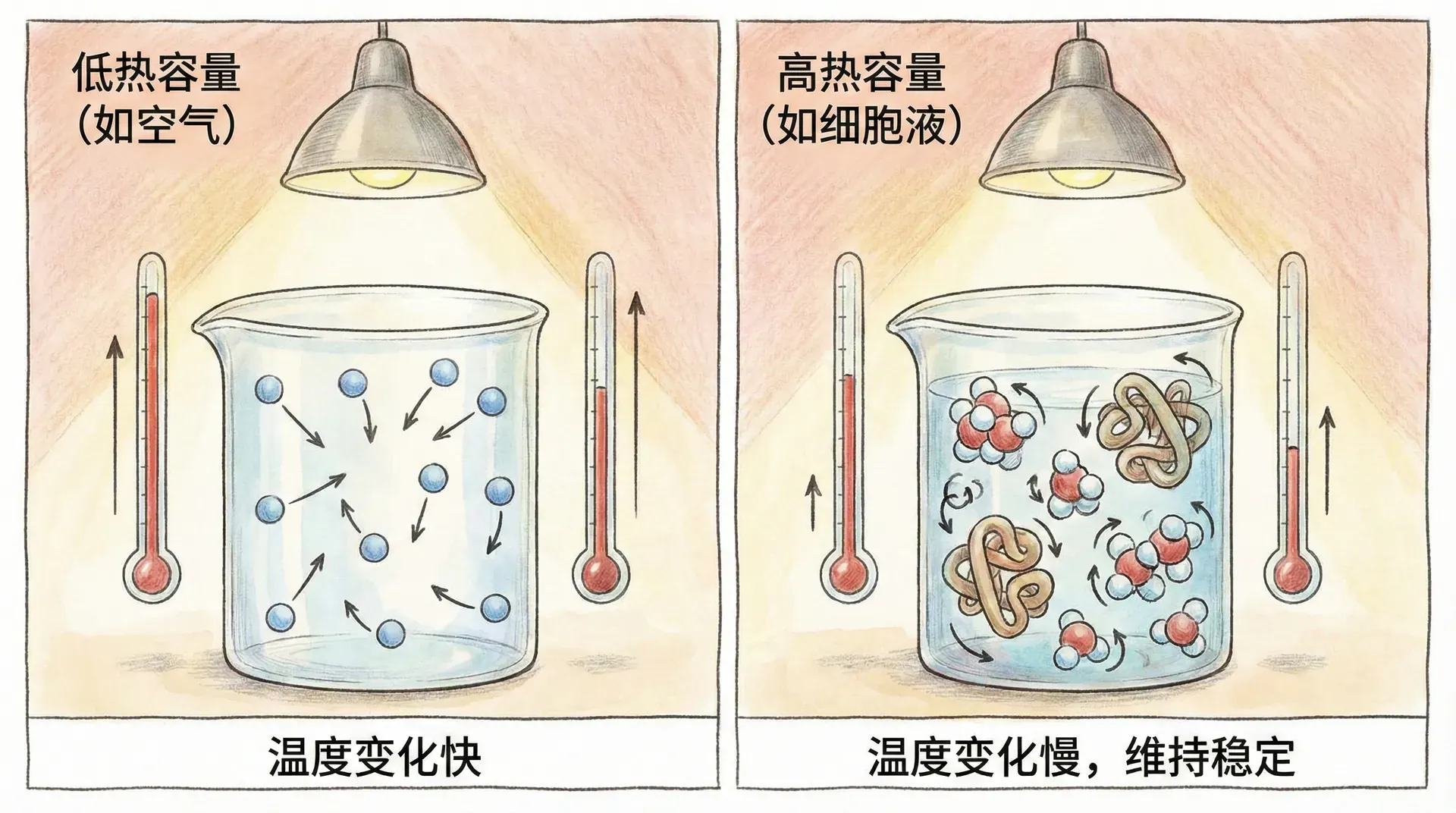
热容量的分子基础
热容量(heat capacity)是用来衡量物质在吸收热量后,温度上升能力的物理量,反映了系统对能量扰动的敏感程度。从分子视角看,热容量与分子的微观运动类型密不可分,这包括平动、转动和振动三大类。
在经典热力学中,热容量的定义为
其中 为热容量, 是吸收的热量, 是温度的微小变化。(常见的还有定压热容量 及定容热容量 的区分。)
对于理想气体分子,其运动模式对热容量的贡献可以总结如下:
例如, 和 尽管理论自由度不同,但由于部分高频振动在常温下难以激发,其振动贡献较低。相比之下,大分子如蛋白质、RNA 拥有众多振动模式,理论热容量远高于小分子。
生物大分子的热容量在特定条件下会发生突变,最常见的是蛋白质的热容量突跃(heat capacity jump)。在蛋白质变性(folded unfolded)、二级结构融解等过程中,热容量表现为阶梯式上升。其本质在于分子的内部自由度暴增,尤其是振动和转动自由度的增加,同时疏水核心的水分子释放进一步提升了系统的整体自由度。
以差示扫描量热法(DSC, Differential Scanning Calorimetry)为例,实验所观察到的热流异常即对应蛋白质结构转折点。常见的DSC曲线如下:
因此,热容量不仅反映了分子的微观运动本质,其突变还常用于生物大分子结构机理的分析与判别。
除蛋白质外,核酸融解、膜结构去稳定等生物过程也存在类似热容量突跃现象,对理解分子的稳定性及其结构动力学同样意义重大。例如 RNA 的二级结构熔解、脂质双层相变等,常常用热容量曲线进行精细描绘。总之,热容量是连接分子结构与能量变化机制的重要纽带。
玻尔兹曼分布与分子能级
玻尔兹曼分布(Boltzmann distribution)描述了在热平衡条件下,体系中粒子分布到各能级的概率规律。具体而言,能量为 的状态所占概率 为:
其中 是该能级的简并度, 是玻尔兹曼常数, 是系统绝对温度, 为分配函数(配分函数):
因此,能量越高的状态,其被粒子占据的概率越低。简要对比如下:
生物化学实例:
- 在常温下,大多数酶或蛋白质分子都以最低能量的构象为主,但仍有极少部分分子能够跃迁至较高能量的激发态或过渡态,这为复杂的功能(如酶的催化循环、蛋白质构象改变、信号转导)提供可能。
- 离子通道的开启、某些配体结合状态等,亦可用玻尔兹曼方程拟合其激活概率。
以酶促反应为例,部分分子由于热涨落达到反应势垒,实现酶-底物复合物向产物态跃迁:
其中 为反应的活化能。
此外,玻尔兹曼分布是分子动力学等计算模拟的理论核心,协助预测样品在不同温度/能量条件下的动力学行为及构象分布。
总结来说,玻尔兹曼分布不仅量化了分子能级间的概率,还在生物体系能量变化、反应动力学、结构动力学等多个层面起着关键性支撑作用,是理解生物体系微观行为的基础。
分子势能的构成与计算
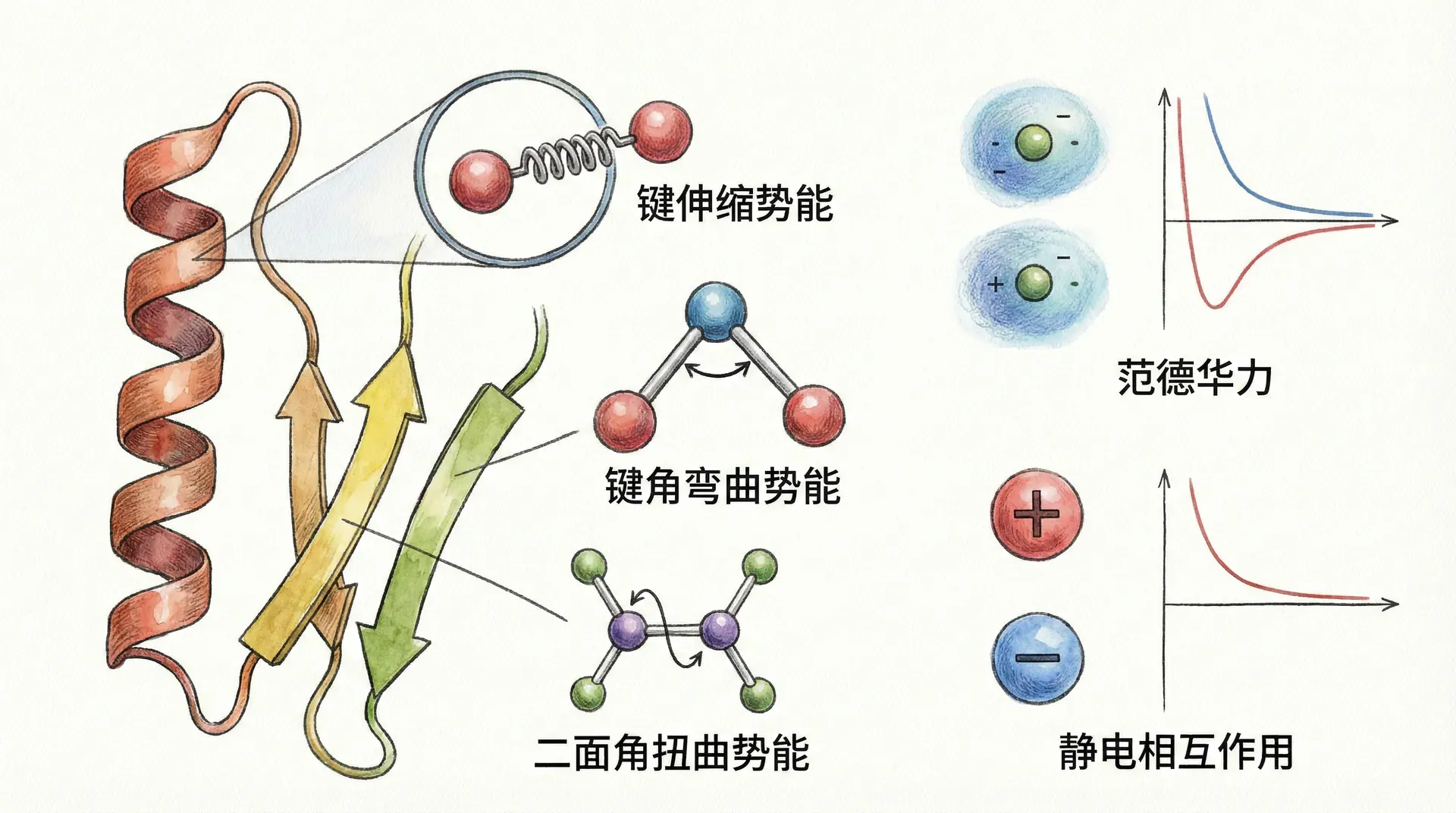
分子势能函数的组成
在分子模拟与理论生物物理学中,生物分子的势能函数(potential energy function,通常被称为“力场”)是描述分子内部原子间和分子间相互作用的数学表达式。典型的分子力场将总势能分为以下几个主要项,每一项都对应物理上的具体作用力:
共价项(键长、键角、扭转角)主要约束生物分子的骨架结构,使分子维持合理空间形状。非共价项(范德华力、静电力)则决定了分子的具体三维形态、分子间的识别与结合,以及像蛋白质折叠和酶催化这样的复杂现象。生物分子的潜能函数通常十分复杂,一些高级力场还会引入氢键、π-π堆积、疏水效应等特殊作用项以更准确地描述实际生物体系。
值得注意的是,势能表面越平坦/柔软,意味着分子构象空间越大,可访问的状态数也就越多,分子的功能多样性和动态性也更为突出。科学家利用这些“力场”既能进行分子动力学模拟,也能定量分析生物分子的能量分布特征和结构转变路径。
范德华相互作用的特点
范德华力(van der Waals interaction)是原子、分子间普遍存在的短程弱力,由三种机制组成:诱导力(感应极化)、取向力(永久偶极相互作用)、色散力(瞬时偶极诱导)。范德华力相较于共价键与离子键来说单个极弱,但在复杂生物体系中,由于原子数量极其庞大,这些弱作用积少成多,成为蛋白质折叠、分子自组装和生物大分子识别中的重要驱动力。
例如,在蛋白质中,疏水氨基酸(如苯丙氨酸、亮氨酸、缬氨酸等)侧链通过排斥水分子,相互聚集于蛋白质内部形成疏水核心,这一聚集主要依赖范德华相互作用维持。当蛋白质变性,疏水核心暴露,导致实施疏水作用的范德华项减少,稳定性下降。此外,范德华力对药物与靶标的结合亲和力也有重要贡献,解释了为何有时即使没有显著的氢键或电荷驱动,分子之间仍可紧密结合。
下面的图表展示了Lennard-Jones势能——经典描述范德华力能量随距离变化的函数:
从图中可见,分子距离很近时,势能迅速变为正值,表现为强烈的排斥作用(原子间轨道重叠);在适中的距离(如3.5 Å左右),势能最低,对应范德华相互作用的最稳定结合距离;距离继续增大后,吸引力逐渐减小并趋近于零。由此,范德华力既能够防止分子过分靠近(保证空间排斥不致塌缩),又能在合适距离显著增强分子间亲合。正是依赖这种“弱而广”的范德华作用,生物大分子体系得以实现高效的自组织、结合和动态调控。
氢键的强度与环境依赖性
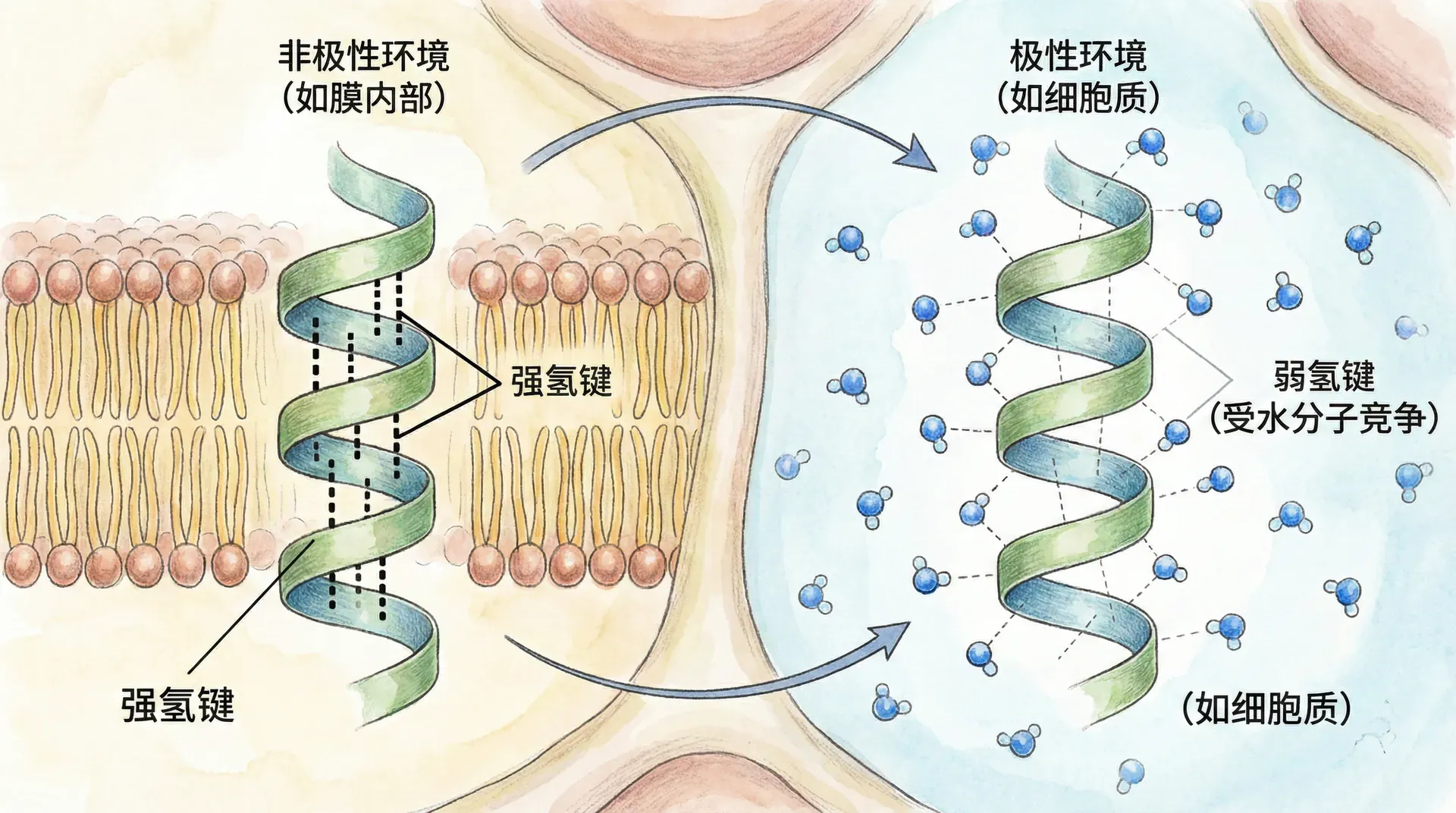
氢键的本质与形成条件
氢键是一种特殊且极为关键的分子间作用力。其形成通常需同时满足下列两个条件:
- 供氢原子与强电负性原子(如O、N、F)共价结合,使氢原子获得部分正电荷();
- 该氢原子以严格的空间取向,与另一具有孤对电子的电负性原子(如O或N)形成桥接,导致氢键具有较强的方向性与特异性。
这种几何定向性,使得氢键对于分子识别和特异构象形成尤为重要。
在生物体系中,氢键的作用极为广泛,不仅限于简单的分子间吸引。例如,DNA双螺旋能够稳定包裹、传递遗传信息,主要依赖两种碱基对间的氢键(A-T有2个氢键,G-C有3个氢键);蛋白质的-螺旋和-折叠的稳定与形成,也都仰赖主链间大量氢键。此外,抗体的抗原识别、酶与底物的高效结合等,也都不可或缺氢键网络的支持。
氢键的强度居于范德华力与共价键之间,数据如下(单位):
这种“强度适中”使氢键即能维持结构稳定,又能在生理条件下可逆断裂,方便分子的动态调控和复杂信号传递。
水环境对氢键强度的影响
水作为生命必不可少的溶剂,同时自身又是高效的氢键供体和受体。在液态水中,每个水分子平均能形成个氢键,这带来对生物分子氢键位点的强烈竞争。例如,在非极性环境或真空中,一个典型的氢键强度可达以上;移至水溶液后,由于水分子的“插足”和竞争,有效氢键常降至。这种现象被称为溶剂化削弱效应,表现为水分子插入原有的氢键网络,可能导致氢键重新分布甚至断裂,并生成桥接氢键结构。
下表对比不同环境下典型分子间氢键的强度:
虽然单个氢键在水环境下显著变弱,但生物大分子通过“氢键网络”的组装,整体稳定性得以大幅提高。例如DNA双螺旋上,每对碱基通过2-3个氢键连接,整个分子存在数百甚至上千个氢键点;蛋白质主链的螺旋和折叠结构同样依赖于高度重复的氢键排列。这种网络效应抵消了单个氢键削弱带来的不稳定,保障了生命信息和结构的可靠性与适应性。
以抗体-抗原结合为例,抗体的互补决定区(CDR)氨基酸通过一系列氢键与抗原表面特定位点识别结合,而水分子的动态插入与迁移则调节和优化该结合的特异性与亲和力。又如,在细胞内RNA剪接体的识别过程中,RNA分子通过氢键与蛋白结构域进行高精准的分子识别。
氢键、盐桥与蛋白质动态的协同
以血红蛋白的氧结合为例,四条多肽链间布满氢键、盐桥与疏水力,维持四聚体刚柔适度的构象。当第一个氧分子结合某亚基后,该亚基构象轻微调整,导致相邻亚基“盐桥断裂/氢键重排”,协同提升其余亚基对氧的亲和力,这就是协同效应的分子基础。类似机制也在离子通道开启、信号感受器激活等重要生命活动中发挥作用。
静电相互作用与蛋白质形状
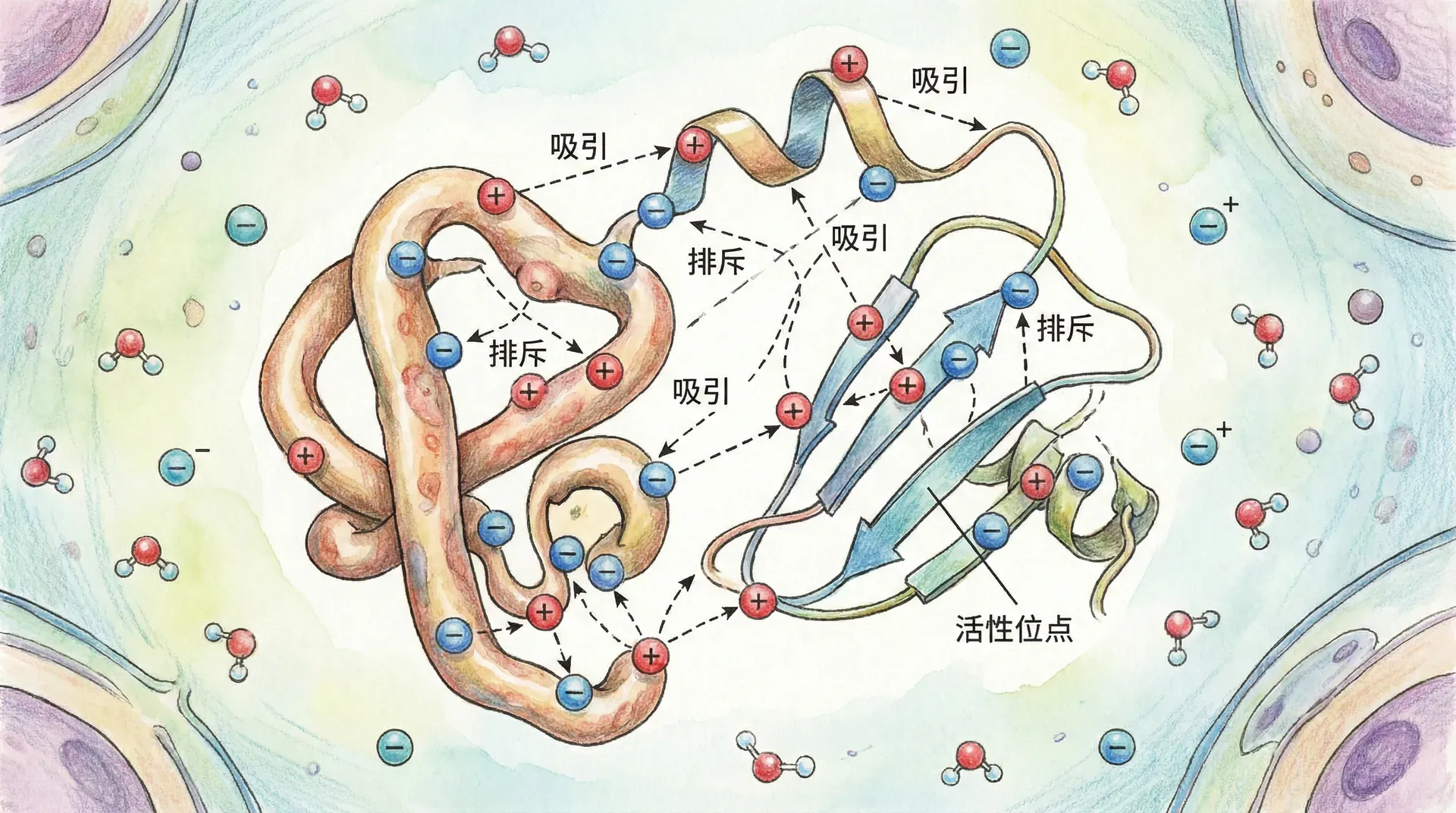
库仑定律在生物系统中的应用
静电相互作用是分子内外带电基团间非常基本且远程的作用力。其能量用库仑定律定量表达:
其中,
- ,为两组分电荷;
- 为距离;
- 是真空介电常数,是介质的相对介电常数(水中,极大降低静电能)。
在生物分子中,精氨酸、赖氨酸(正电),谷氨酸、天冬氨酸(负电)之间可以形成结构。这些盐桥极大提升蛋白质的结构稳定性、调控催化活性及分子识别能力。尤其在膜蛋白和大分子复合体中,静电力常常促进远距离识别和定位。
蛋白质表面电荷分布不仅影响与其他分子的结合,还决定了其在细胞内的“准星”定位。例如,细胞色素c表面富集正电荷区,使其与带负电的细胞色素c氧化酶结合更加高效,从而高效完成电子传递;蛋白-核酸互作、蛋白-蛋白互作的特异性很多都与静电互补协调有关。
蛋白质形状对静电场的调控
蛋白质的三维空间构象高度影响其静电势分布。通过高级折叠,蛋白能将特定电荷基团精确分布于表面、结合腔或活性中心。例如,很多酶的催化口袋局部极性/带电氨基酸(如Arg, Asp, Lys, Glu)高度富集,建立微环境静电场来诱导底物定向、过渡态稳定,最终显著提升催化效率。
以丝氨酸蛋白酶为例,其经典催化三联体(Ser195-His57-Asp102):
- Asp102 的负电荷通过氢键影响 His57 电荷分布;
- His57 作为碱接受 Ser195 羟基氢,促进其亲核性;
- 反应期间,静电场/氢键网络的重新分布调控催化循环各环节的能垒。
上图展示蛋白质表面静电势的空间分布:红色区域为负静电区(富集负电氨基酸,利于正电配体结合),绿色区域为正静电区(常见活性中心或底物结合位点,提升底物识别与催化效率)。蛋白质分子通过灵活调配形状和电荷分区,在生命活动中的分子识别、信号调控、折叠等诸多环节实现高效精密的调节。例如,胰岛素受体分子的结合界面、离子通道门控区、转录调控因子的结合区域,都依赖于局部静电势和构象变化的协同调控。
分子间相互作用的协同效应
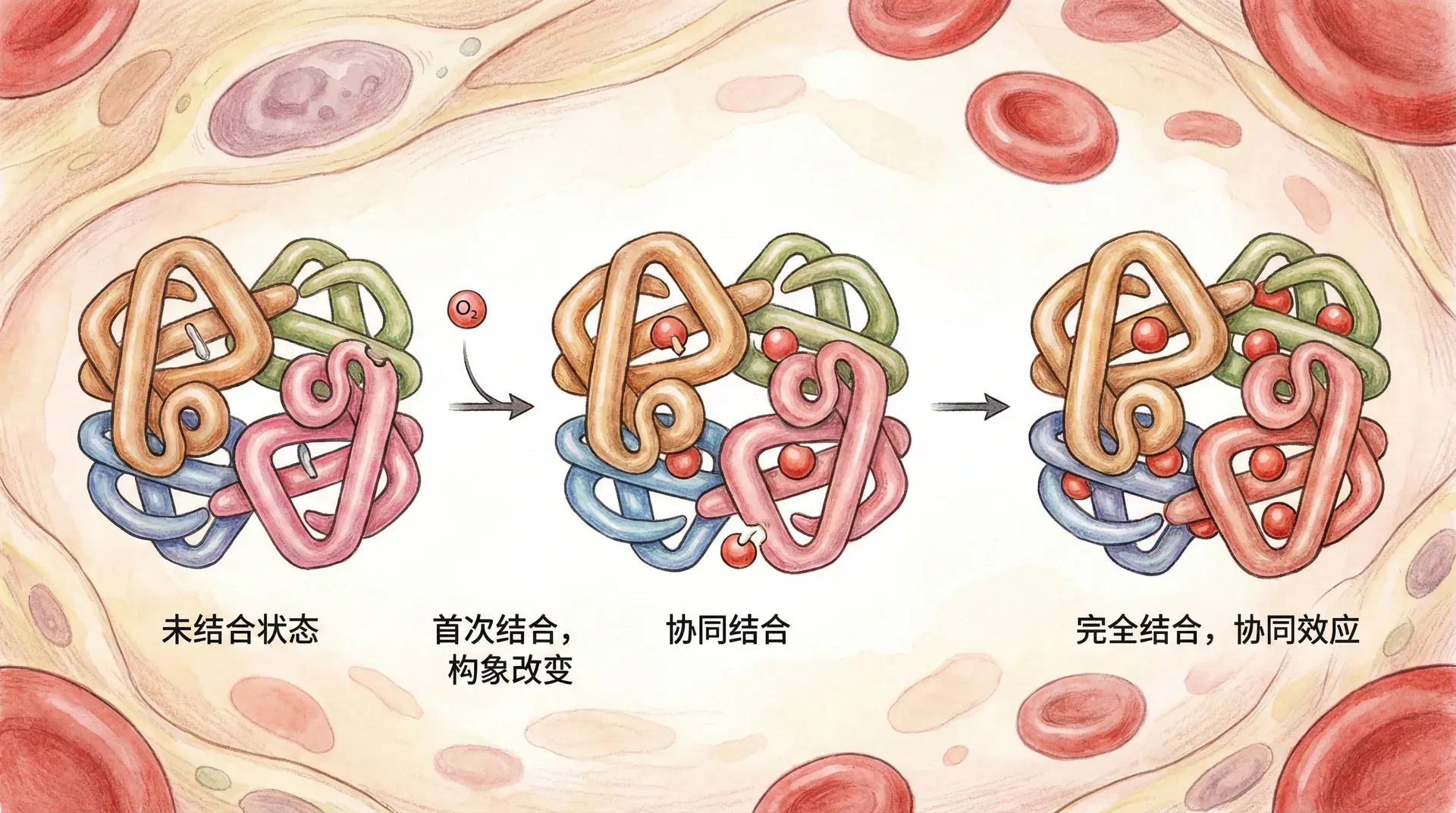
在生命体系中,分子间很少单独依靠某一种作用力。氢键、疏水作用、静电力和范德华力通常交织协作,互为补充,形成复杂稳固的分子网络。这种多力协同,保障了蛋白质、核酸等大分子的正确折叠和功能实现。例如,蛋白质折叠时,疏水效应促使非极性侧链聚集形成核心,氢键与盐桥则交织分布以稳定空间结构,范德华力微调原子间距离,使整体布局更精细。正如中医的“君臣佐使”,各类作用力各司其职、协作互补,赋予生命体系高度的灵活性和动态调控能力,使生物体能应对环境变化并完成多样复杂的分子功能。
温度作为生物体系中最敏感的外部变量,对分子间作用力影响深远。氢键和静电作用依赖分子的定向吸引,高温下分子运动剧烈,这些短程作用力容易被扰乱,从而降低蛋白质等生物大分子的稳定性。相反,疏水相互作用在适宜温度内随温度升高反而增强,因为高温促使水分子从疏水面脱离,加剧疏水基团聚集。这种温度依赖不仅决定生物的适生温度,也推动分子进化,如极端生物的蛋白往往通过增多氢键和盐桥、优化疏水核心适应环境。在人体37°C时,绝大多数蛋白质处于活性最优、稳定性最高的状态,这正是分子间协同力动态平衡的体现。
理解能量与分子间作用力的协同原理,不仅助力基础科研,也推动着新药开发、蛋白工程和先进生物材料创新。通过调控、模拟这些作用力,可以理性设计出高效酶、精准靶向药物、智能响应材料,甚至合成新型生物体系。这些基础理论已成为现代生物与医学工程的核心支撑。
总结来看,生物系统能量变化与分子间作用力既遵循严格的物理化学规律,更体现出协同效应的重要性。热力学第一定律保证能量守恒,分子力的耦合与动态调节则决定了生物多样性和高度有序结构的维持。这些理解为系统性生命科学的理论和研究奠定了坚实基础。