糖类与脂质
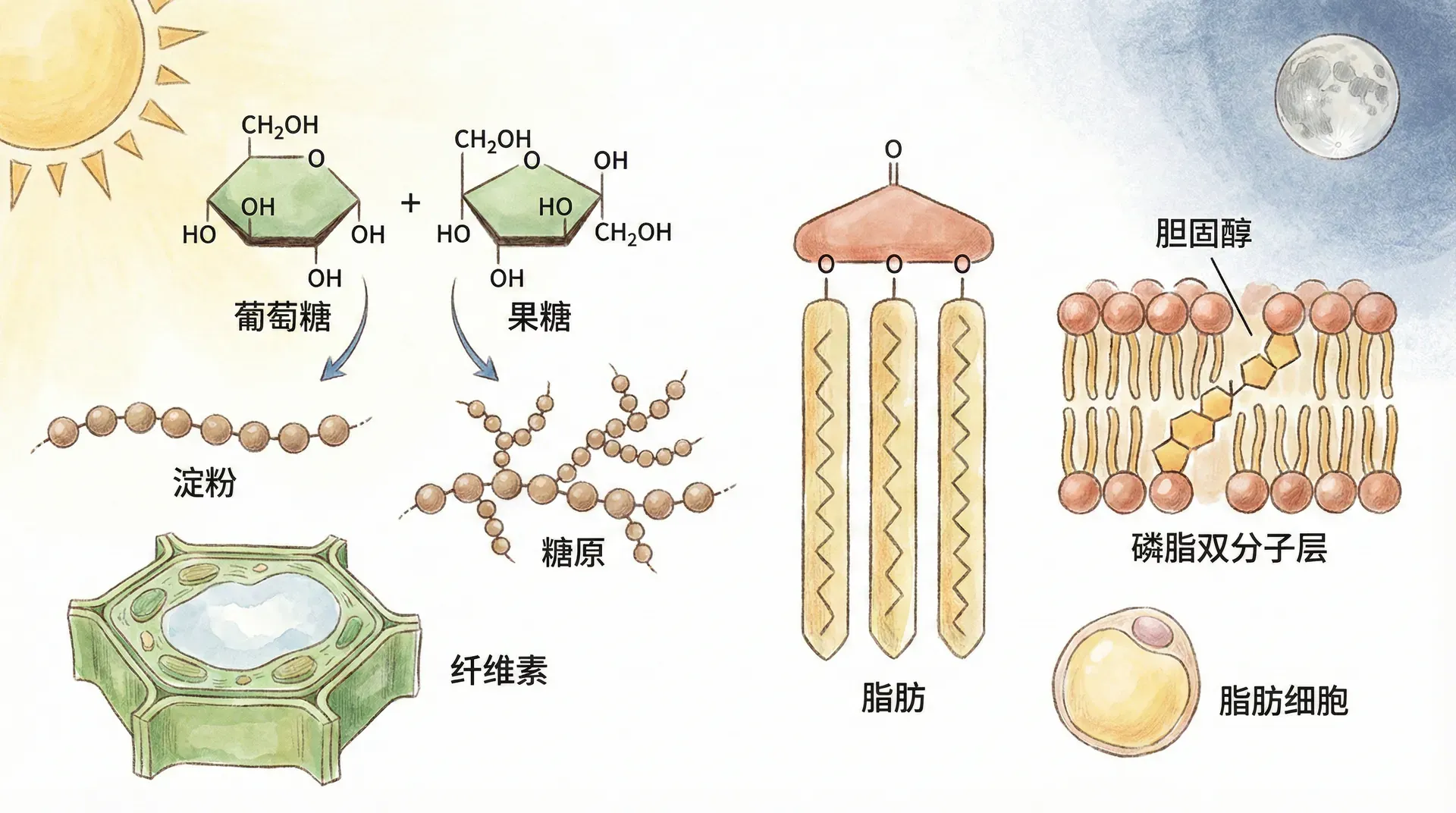
糖类和脂质是构成生命体系的两大重要分子类群。在生物体中,糖类和脂质不仅为细胞提供了坚实的结构支撑,更在能量储存、能量代谢、细胞通讯、信号转导和细胞识别等生理过程中发挥着不可替代的作用。糖类例如葡萄糖,是生命体最直接且普遍的能量来源;而复杂的多糖如肝糖原和淀粉,则起到能量储存的“电池”作用。脂质方面,磷脂是生物膜的基础骨架,胆固醇则调节膜流动性,三酰甘油作为关键能量储存形式支撑着动物在饥饿和运动时的能量供应。此外,脂质还能衍生出许多重要的信号分子,如激素和前列腺素,参与机体内信号的快速传递和调控。
在我们日常生活中,这些分子同样无处不在地影响着生命活动的每一个环节。无论是米饭中的淀粉、牛奶里的乳糖,还是细胞膜上的磷脂双分子层、芝士与坚果中的脂肪酸,它们不仅参与维持生命的基本运行,也深刻影响着我们对能量和健康的认知。例如,血糖水平的调节是生理稳态中至关重要的一环,脂肪的储存和动用更与人类的进化和适应能力息息相关。
单糖的分子世界
单糖的基本结构
单糖作为糖类的基本组成单位,其分子结构虽然相对简单,但却蕴含着丰富的化学变化可能性。以葡萄糖为例,这种我们熟悉的糖分子具有化学式 C₆H₁₂O₆,看似平凡的组成却能够形成多种不同的空间构型。
在水溶液中,葡萄糖主要以环状结构存在。这种环化反应是分子内的醛基与羟基之间形成半缩醛键的结果。就像折纸艺术一样,同样的纸张可以折成不同的形状,葡萄糖分子也能够通过不同的折叠方式形成α型和β型两种异构体。
在室温下的葡萄糖溶液中,α型葡萄糖约占36%,β型葡萄糖约占64%,两者通过开环-闭环的方式不断相互转换,这一现象被称为变旋光现象。
这种构象变化的生物学意义远超我们的想象。不同的构象决定了糖分子在生物体内的识别和结合特性。例如,α-1,4糖苷键连接的淀粉在人体内可以被淀粉酶轻易分解,而β-1,4糖苷键连接的纤维素却无法被人体消化酶识别。这就解释了为什么我们能够从米饭中获得能量,却无法消化纸张或木材中的纤维素。
异构体的奥秘
单糖的异构现象为我们展示了分子层面的精密设计。以最简单的己糖家族为例,葡萄糖、果糖和半乳糖虽然都具有相同的分子式C₆H₁₂O₆,但它们的立体结构差异却带来了截然不同的生物学特性。
在中国传统糖制品的制作过程中,我们可以观察到这种分子差异的实际影响。麦芽糖是由两个α-D-葡萄糖通过α-1,4糖苷键连接而成,它的甜度约为蔗糖的三分之一。而果糖虽然与葡萄糖只是羰基位置的不同,但其甜度却是葡萄糖的1.7倍,这就是为什么水果尝起来格外香甜的分子基础。
这种立体化学的精确性在生命体系中具有重要意义。人体内的酶系统能够严格区分这些异构体,这种分子识别的精确性堪比锁与钥匙的关系。例如,人体肝脏中的己糖激酶对不同己糖的催化效率差异可达数千倍,这种选择性确保了细胞代谢的有序进行。
糖分子的构象动力学
单糖分子在溶液中的构象变化是一个动态平衡过程。这种分子运动为我们理解糖类的生物学功能提供了重要线索。葡萄糖分子从开链形式到环状形式的转换过程中,涉及到分子内氢键的重新排列和空间构象的调整。
在生理条件下,这种构象变化的速率约为每秒数千次。虽然开链形式在平衡状态下的比例不足0.1%,但正是这种极少量的开链形式为糖类的化学反应提供了活性位点。这就像舞蹈中的瞬间造型,虽然时间短暂,但却是整个舞蹈动作连贯性的关键。
糖链的复杂性与功能多样性
从单糖到多糖的多级构建
糖分子通过多种糖苷键精巧地连接,形成了结构与功能各异的多糖,极大地扩展了生命分子的复杂性。这一过程就如同字母拼写出无穷单词,不同的单糖以不同位置、不同键型(如α或β)相连,产生了多样化的巨分子。例如蔗糖、乳糖、麦芽糖这三种双糖,虽都由葡萄糖衍生而来,但连接方式不同,风味、生理作用大相径庭。
下表展示了常见多糖的结构特征和功能差异:
米饭的口感差异便源自多糖的结构:含直链淀粉较多的籼米饭粒粒分明,便于炒制;含支链淀粉丰富的糯米则呈现极佳的黏性,适合包裹、搓揉,成为汤圆、粽子的基础。事实上,支链淀粉分子分支点的形成依赖于特定酶系统,一粒完整的支链淀粉分子往往含百万级别葡萄糖单元,分支约每25个葡萄糖单位出现一次。
多糖分支与意义
糖链的分支结构不仅调节多糖的理化性质,也决定了其在生命体中的功能。与直链结构相比,分支结构大幅提升了分子表面积,为酶反应提供更多结合位点。这种设计对于动物体内的糖原尤为重要,其每8-12个残基就有一个分支点,使其可被多个酶头同步降解,确保运动或应激时快速供能。
日常饮食中的应用也受到分支结构所影响,如汤圆、年糕等黏弹性食品需用支链淀粉高的糯米粉,而米饭、炒饭等讲究粒粒分明时,就偏向于选直链淀粉含量高的稻米。面点师傅在和粉时常以感官判断糊化性能,实则背后正是多糖分支精密调控的结果。
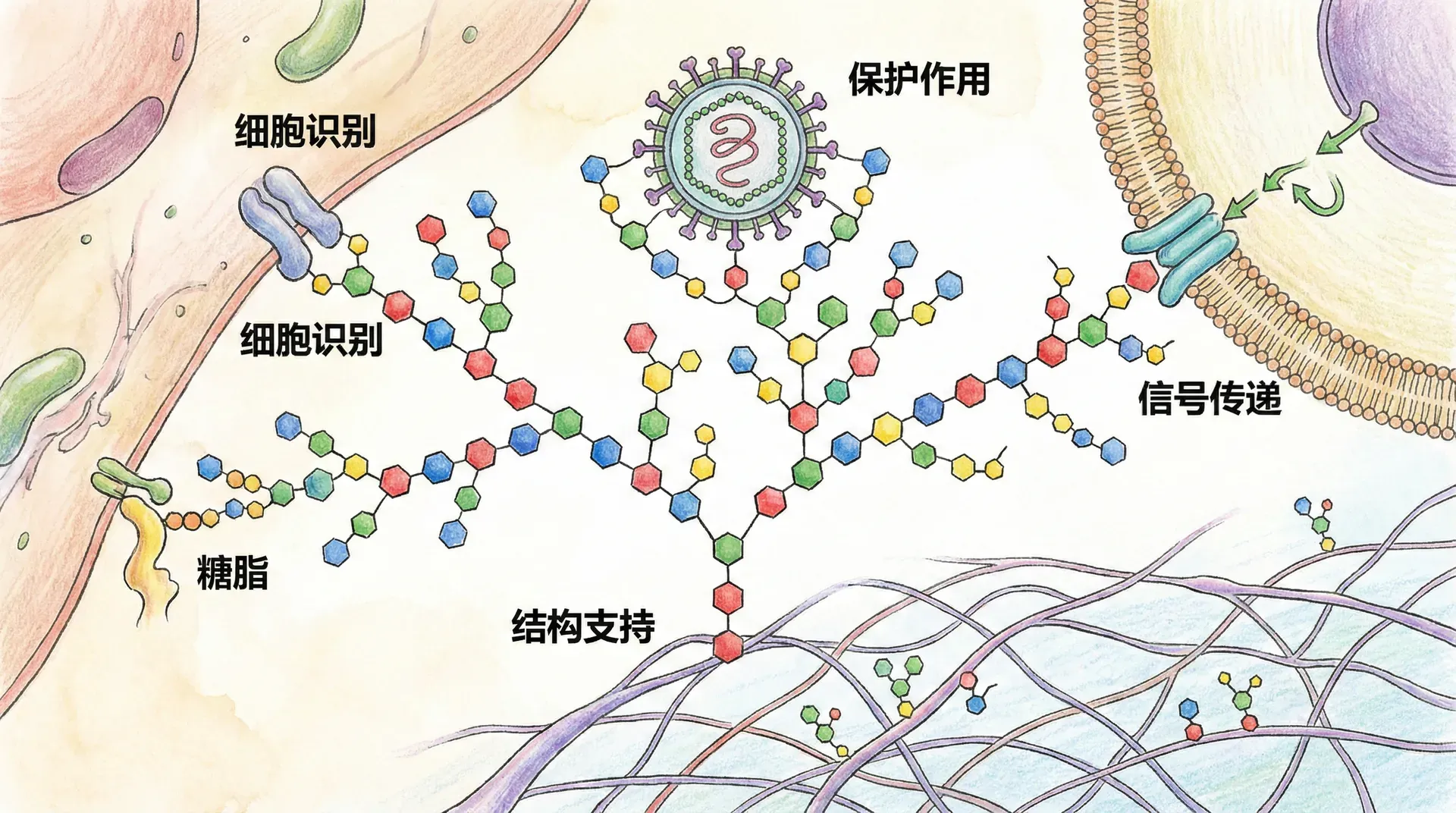
糖蛋白与分子识别密码
糖类修饰蛋白质形成的糖蛋白,是细胞表面信号识别和分子通讯的关键。糖链宛如分子级“身份证”,指导细胞间的准确对话。许多病毒、细菌的入侵也常借助于对宿主细胞糖链的识别与结合。
最著名的实例之一是人类ABO血型系统。其分子基础就在于红细胞表面糖蛋白上的末端糖链种类不同:
这种极细微的糖链差别,会造成强烈的免疫排斥反应,直接影响输血兼容性。除此之外,很多激素受体、粘附分子、免疫分子的功能都依赖于表面糖链对合作分子的精准“解码”。
蛋白质糖基化
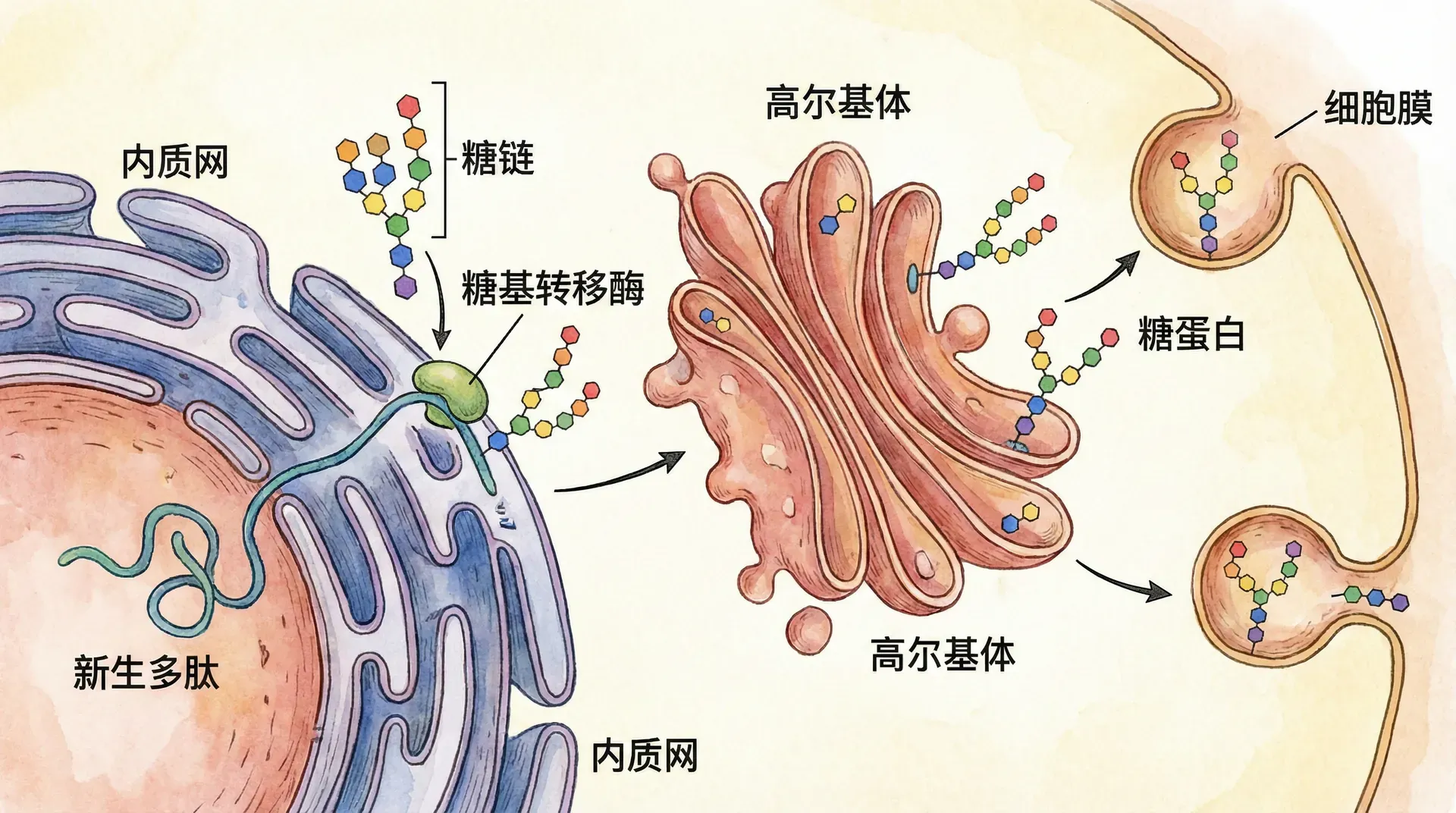
糖基化修饰的基本机制
蛋白质糖基化是高度复杂且非模板调控的生命化学过程。与DNA转录、蛋白翻译等一一对照的模板反应不同,糖基化是在特定酶的协同作用下,在内质网和高尔基体完成的“自助组装”。几十种酶按照严格的时空序列对蛋白质进行改造,工序相互衔接却又带有一定“随机性”,因此同一种蛋白最终可出现多种糖链修饰的“变体”。
例如,N-连接型糖基化过程涉及上百种基因产物和超过30种不同酶的参与——每一步“加工”都为终产物带来微妙差异,增加了生命系统调节的阈值和灵活性。
蛋白质糖基化的非模板性意味着即便蛋白质产自同一基因,不同细胞、不同环境条件下可能呈现不同糖链修饰。正是这种“微观异质性”赋予了蛋白质更加精细和多样的功能调节能力。
糖基化对蛋白质性能的影响
蛋白质糖基化大幅改变其理化性质和生命功能:
- 增强亲水性:糖链携带大量极性基团,提高蛋白的水溶性,是许多分泌蛋白、膜蛋白正常功能的前提。
- 稳定结构:糖链包覆蛋白表面形成“糖帽”保护层,有效减少热变性。例如极端环境生物的蛋白质大多高度糖基化,以应对高温、强酸等恶劣条件。
- 抵抗降解:糖链可阻止蛋白酶识别和切割,提高蛋白分子的“半衰期”,常见于激素或部分酶类的持续调节。
糖基化异常与疾病
当蛋白质糖基化调控失常时,会直接或间接导致疾病。最为人熟知的例子是糖尿病患者的糖化血红蛋白(HbA1c):血糖过高时,葡萄糖以非酶促方式和血红蛋白结合,生成稳定的糖化产物,HbA1c浓度正好反映了过去2-3个月的平均血糖。如今HbA1c已成为糖尿病诊断和血糖长期管理的重要指标。
此外,肿瘤细胞表面常出现异常的糖基化修饰,这些异常糖链不但影响细胞识别和转移,还能作为癌症诊断的新型分子标记,为个性化治疗提供了新的思路与靶点。
脂质分子的自组装原理
脂质分子的两亲性特征
脂质分子的最大特征在于其两亲性结构,即同时具有亲水的极性头部和疏水的非极性尾部。这种分子设计使得脂质在水环境中表现出独特的自组装行为。就像磁铁的同极相斥、异极相吸一样,脂质分子在水中会自发地排列,使疏水部分相互聚集,亲水部分与水分子接触。
以磷脂酰胆碱为例,其分子结构包含一个含磷酸基团的亲水头部和两条脂肪酸链组成的疏水尾部。在水溶液中,这些分子会自发形成双分子层结构,亲水头部朝向水相,疏水尾部相互交错形成疏水核心。这种自组装过程完全由热力学驱动,不需要外界能量输入。
膜结构的形成机制
细胞膜的形成是脂质自组装的杰作。在生理条件下,磷脂双分子层自发形成封闭的囊泡结构,这种结构为细胞提供了与外界环境的边界。膜的形成不是随机过程,而是由分子间相互作用的精确平衡决定的。
疏水相互作用是驱动膜形成的主要力量。当脂质分子的疏水尾部暴露在水环境中时,会导致周围水分子的重新排列,这种熵减过程在能量上是不利的。因此,脂质分子倾向于将疏水部分聚集在一起,形成疏水核心,从而最小化与水的接触面积。
膜厚度的确定也遵循着精确的物理化学原理。典型的生物膜厚度约为4-5纳米,这个尺寸恰好使得膜两侧的亲水头部能够与水充分接触,同时保持疏水核心的稳定性。这种厚度也与膜蛋白的跨膜结构域长度相匹配,确保了膜蛋白的正确折叠和功能。
脂质组成的多样性
生物膜并非单一脂质的简单聚集,而是多种脂质分子的复杂混合物。不同脂质的混合比例决定了膜的物理性质和生物功能。磷脂酰胆碱提供膜结构的主要骨架,磷脂酰丝氨酸赋予膜内侧负电荷,胆固醇调节膜的流动性,鞘脂参与信号传导。
在中国传统医学中,人们很早就认识到了不同食物对“血脉”的影响。现代科学研究表明,这种影响的分子基础正是膳食脂质对细胞膜组成的调节。例如,富含ω-3脂肪酸的鱼类能够改善细胞膜的流动性,而饱和脂肪酸含量过高则可能导致膜的僵化。
膜的流动性与相变
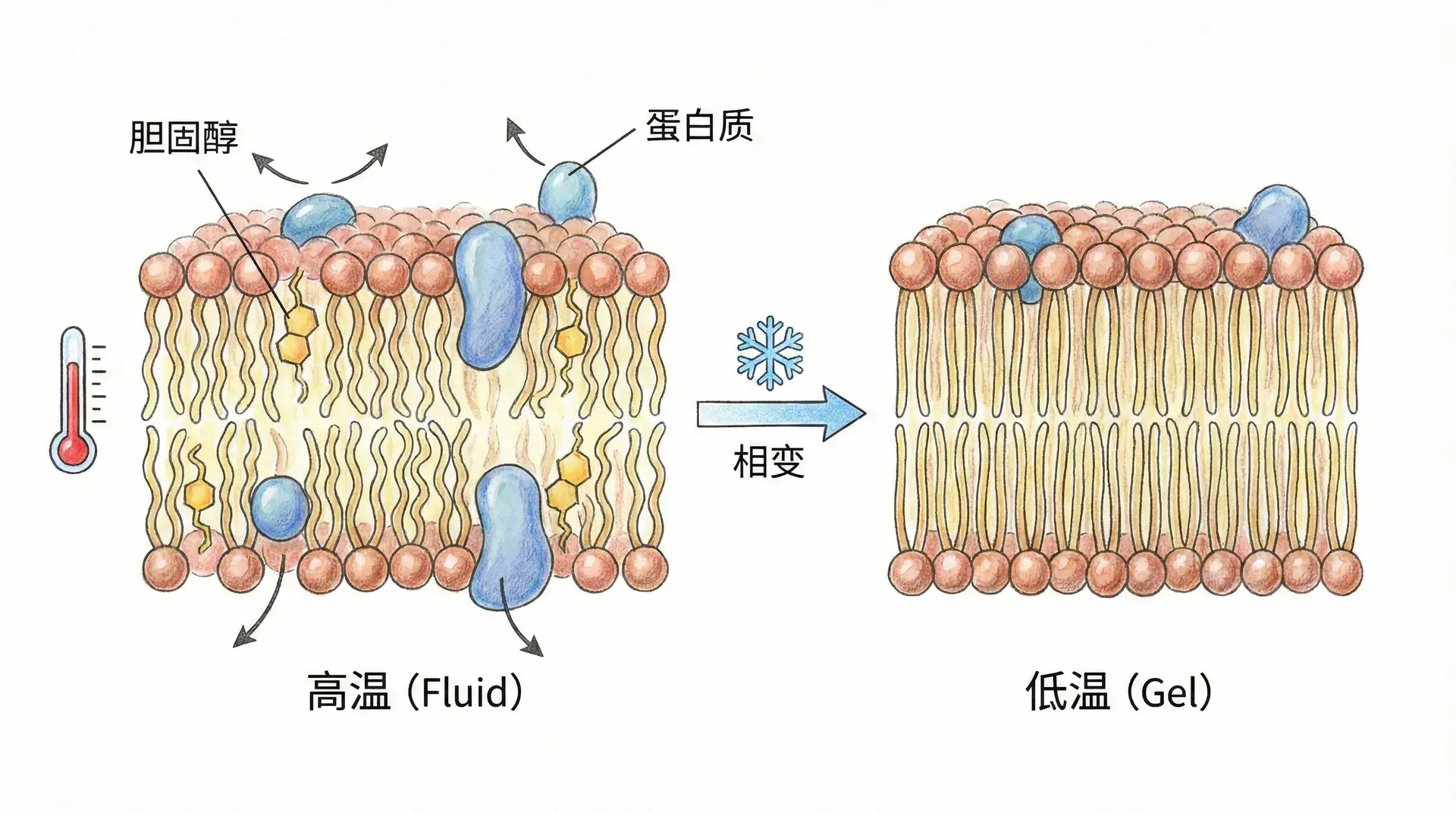
温度对膜性质的调节
细胞膜的流动性是一个温度敏感的性质,这种敏感性对细胞的正常功能至关重要。在生理温度下,细胞膜处于液晶态,具有适中的流动性,既能维持膜的完整性,又允许膜蛋白的构象变化和小分子的跨膜转运。
当温度降低时,脂质分子的热运动减弱,分子间的范德华相互作用增强,膜逐渐从液晶态转变为凝胶态。这种相变过程类似于水结冰的过程,但更加复杂。不同的脂质具有不同的相变温度,这种差异为细胞提供了调节膜性质的机制。
在寒冷地区生活的动物,其细胞膜中不饱和脂肪酸的比例往往较高。不饱和键的存在引入了分子的弯曲,防止脂质分子过于紧密排列,从而保持膜在低温下的流动性。这种适应机制被称为“膜适应性”,体现了生物体对环境变化的分子水平响应。
胆固醇的调节作用
胆固醇在调节膜流动性方面发挥着独特作用。这种分子具有刚性的固醇环结构和柔性的烷基链,使其能够同时影响膜的有序性和流动性。其调节作用的具体表现如下:
这种双向调节机制使得含有胆固醇的膜在较宽的温度范围内保持相对稳定的流动性。人体细胞膜中胆固醇含量约占总脂质的30-50%,这一比例经过进化优化,确保膜在体温附近具有最佳的性质。
胆固醇的这种调节作用也解释了为什么某些疾病会影响细胞膜功能。例如,家族性高胆固醇血症患者由于胆固醇代谢异常,细胞膜的组成发生改变,可能影响膜受体的功能和信号传导过程。
膜微结构域的形成
现代研究发现,细胞膜并非均匀的脂质海洋,而是存在着具有不同组成和性质的微结构域。这些微结构域,也称为“脂筏”,富含胆固醇和鞘脂,具有较低的流动性。
脂筏的存在为膜蛋白提供了特殊的环境,许多重要的细胞过程,如信号传导、胞吞作用和病毒感染等,都与脂筏密切相关。脂筏的形成同样基于脂质的自组装原理,但涉及更复杂的分子间相互作用。
在传统中医的“气血”理论中,强调了“血脉”通畅的重要性。从现代分子生物学角度理解,这种通畅性很大程度上依赖于细胞膜的正常流动性和微结构域的动态平衡。
糖脂复合物与细胞识别
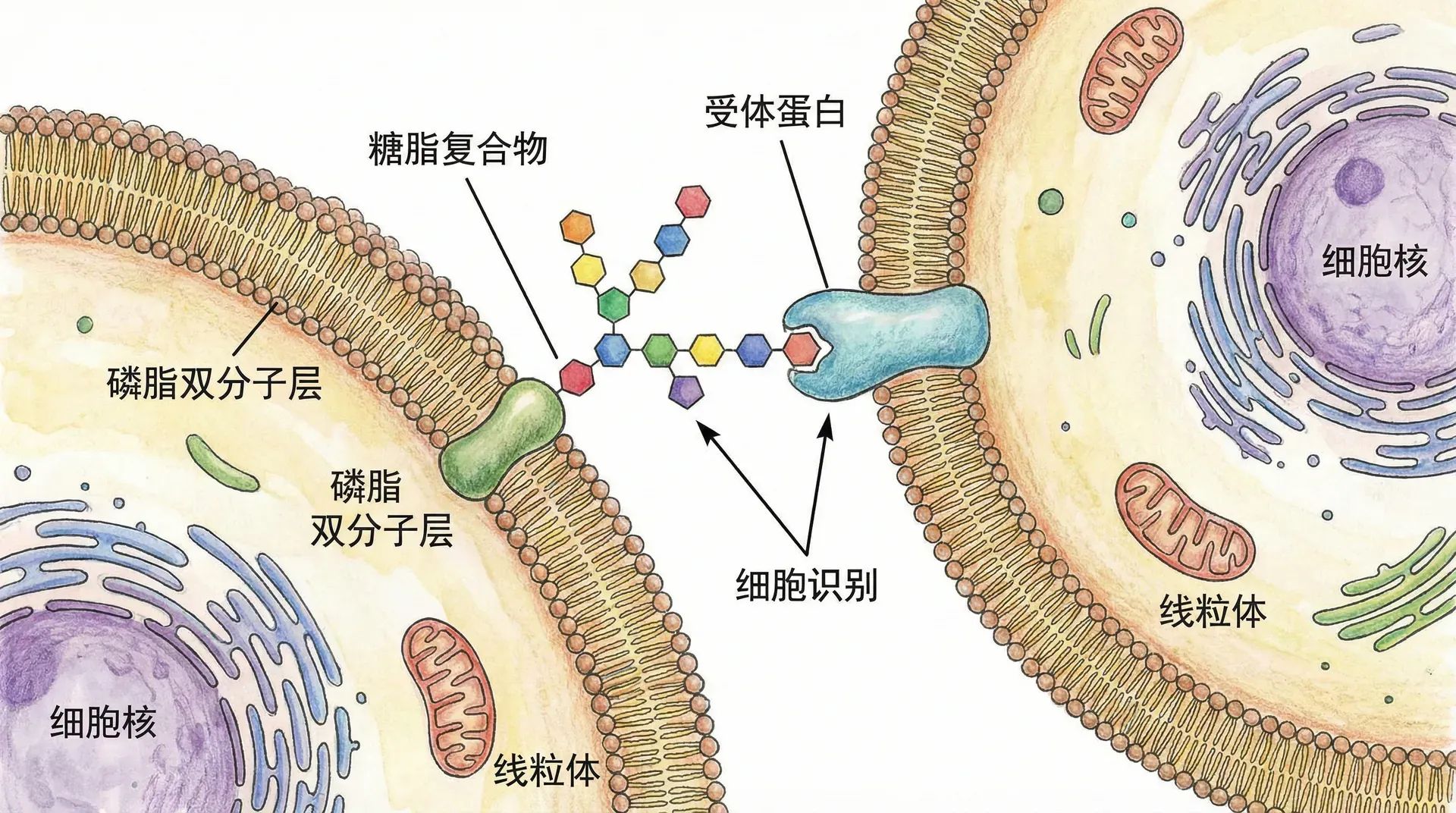
糖脂的结构特征
糖脂是由糖类和脂质分子共价结合所形成的复合大分子,广泛存在于真核生物的细胞膜外层,尤其是在神经组织和免疫细胞表面更为丰富。常见的糖脂有神经节苷脂、脑苷脂等。与普通磷脂不同,糖脂的亲水头部由一个或多个复杂的寡糖链(而非简单双电荷基团)构成,其寡糖链可包含葡萄糖、半乳糖、岩藻糖、唾液酸等多种单糖单位。这些附着在细胞膜外表的寡糖链,伸展于细胞外围,形成一个独特且富有结构层次的“糖被”(glycocalyx)。
细胞表面的“糖被”不仅明显增厚了膜的厚度,还显著提升了细胞膜分子的多样性和特异性。人体细胞表面已知的糖脂种类超过200种,这些糖链的结构差异为细胞赋予“分子身份证”。例如,红细胞表面的糖脂类型和排列组合直接决定了血型(A/B/O/AB型),这正是糖链识别的典型例证。
除了参与血型决定外,不同组织或器官的糖脂分布模式也具有明显的区域性。例如,神经系统中的神经节苷脂种类丰富且特异,有助于神经元间的识别和突触形成,而肝脏细胞表面的寡糖链组合则与肝脏特异性代谢及识别密切相关。糖脂的极性头部还能通过吸附水分子形成局部微环境,保护膜蛋白的构象和活性,对细胞信号感应和环境适应有重要意义。
细胞识别的分子机制
糖脂在细胞识别中的作用主要依赖于与特定蛋白——凝集素(lectin)的结合。凝集素是一大类能特异性识别寡糖序列的蛋白,可以存在于动物、植物和微生物中。在体内,细胞间的信息传递和粘附常常通过凝集素与糖链的相互作用来完成。这种识别高度专一,类似抗体与抗原“锁钥”式结合。例如,肝细胞表面的糖脂通过与微血管内皮的凝集素配对,实现肝脏对循环分子的筛选与归巢。
糖脂—凝集素分子互作不仅仅局限于细胞间通讯,在发育和免疫过程中极具调节价值。例如:
- 胚胎发育:细胞表面独特的糖链“指纹”指导着细胞迁移、归队与分化。神经元生长时,突起导向蛋白能够识别目标细胞表面的特定寡糖,实现神经环路连接的精确构建;血管新生和组织边界的设定也离不开“糖被”信息的正确读解。
- 免疫识别:在感染和损伤部位,糖脂的变化成为白细胞招募、肿瘤细胞免疫监视及器官移植排斥等过程中的“分子信号灯”。某些肿瘤细胞通过改变表面糖脂结构来“逃避免疫”,而早期肿瘤筛查和影像定位也正是利用了这些异常表达的糖脂标志物。
许多病毒和细菌也会“利用”这些识别体系侵入宿主细胞。比如,流感病毒表面血凝素蛋白高效结合细胞膜上的唾液酸,完成感染第一步;幽门螺杆菌亦可黏附特定糖脂在胃中扎根。正因如此,人工阻断糖脂—凝集素互作成为了抗病毒、抗菌药、疫苗研发的新策略。
现代肿瘤分子医学还揭示:大量恶性肿瘤细胞表面会异常表达某些糖脂,如Sialyl-Tn抗原、Lewis抗原等,这不仅促使肿瘤细胞具备更高的侵袭性和免疫逃逸能力,还成为液体活检、分子影像、靶向治疗中理想的分子标靶。例如,某些新型抗体药物就是通过识别肿瘤相关糖脂,将毒素或放射性因子精准递送至癌细胞表面,从而提高治疗选择性并减少副作用。
因此,糖脂通过丰富多样的分子结构和与特异性蛋白的精准互作,成为细胞间识别、信号交流和环境适应的核心分子之一,极大扩展了细胞生物学和医学研究的疆界。
总结
糖类和脂质作为生命体系的重要组成部分,展现了分子设计的精妙和功能的多样性。从单糖的立体化学到复杂多糖的分支结构,从脂质的自组装到膜的动态调节,每一个层次都体现了生物系统的精确性和适应性。
理解糖类和脂质的分子特性不仅有助于我们深入认识生命现象的本质,也为疾病的预防和治疗提供了分子水平的指导。
在现代生物医学研究中,糖类和脂质的研究正朝着更加精细化的方向发展。糖组学和脂质组学等新兴学科的出现,使我们能够系统地分析细胞中糖类和脂质的种类、含量和修饰状态。这些技术的发展将为个性化医疗和精准治疗提供新的可能。
同时,对这些生物分子的深入理解也推动了生物材料和药物递送系统的发展。仿生膜材料、糖基化药物和脂质纳米载体等新技术的出现,展示了基础研究向应用转化的巨大潜力。