=# 生命的化学基础
生物体内的每一个生命现象都离不开化学反应的参与。就像深圳湾红树林中的招潮蟹挥舞着巨大的螯足震慑入侵者一样,生物体也有着精巧的化学防御机制。当我们在广西桂林的溶洞中看到石钟乳时,会惊叹于大自然化学作用的神奇力量,而生物体内发生的化学反应同样令人叹为观止。
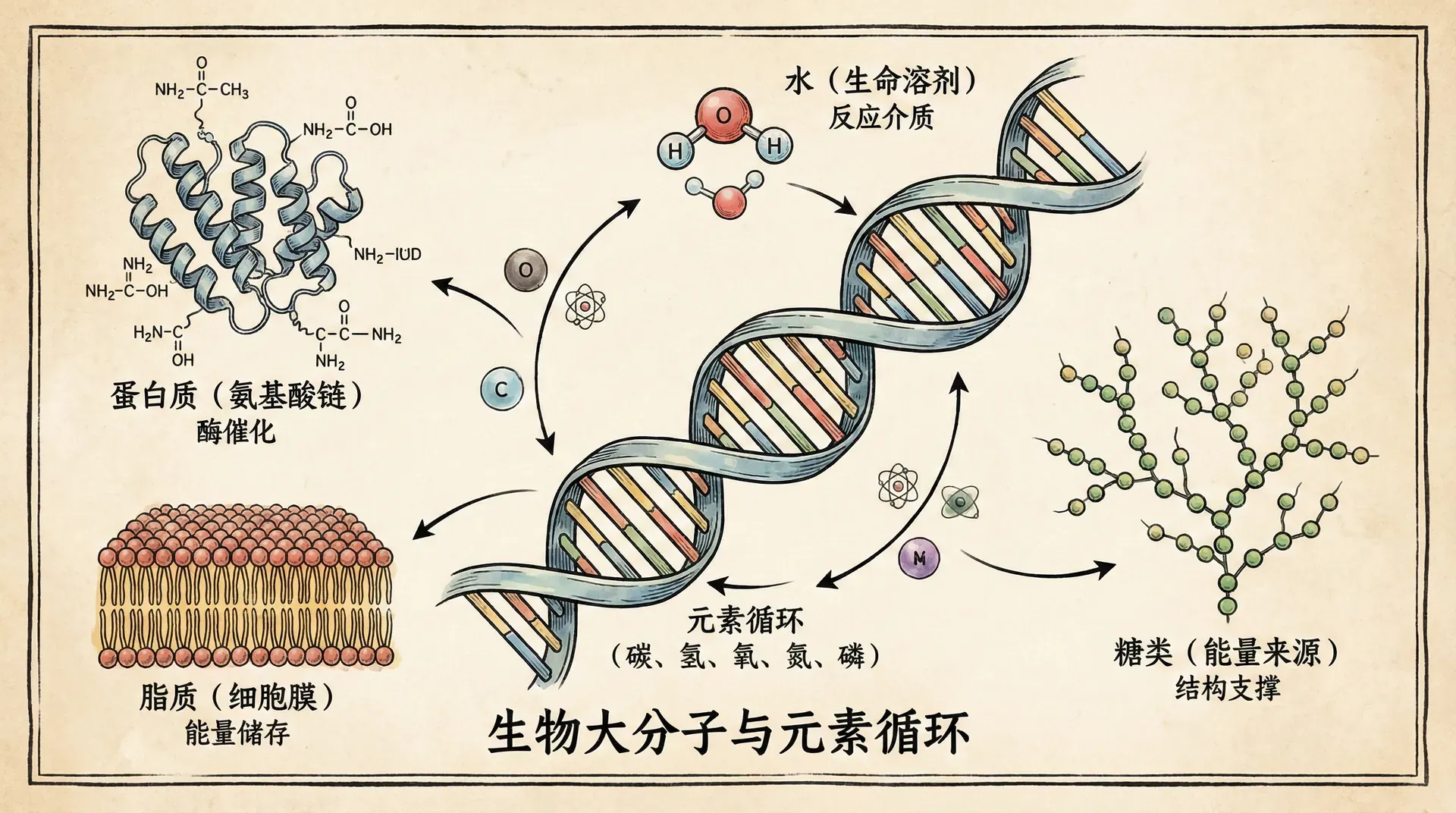
生物学研究生命现象,但生命现象的本质是化学反应。从分子到细胞,从简单的化合物到复杂的生物大分子,化学为我们理解生命提供了基础框架。今天我们将探讨构成所有物质的基本化学成分,为后续理解生物大分子打下坚实基础。
构成生命的化学元素
生命必需的基本元素
在自然界已知的92种元素中,大约20-25%是生物体维持正常生理活动必不可少的。这些必需元素在不同生物间虽有相似性,但也存在差异——人体需要25种元素,而植物只需要17种。
四种主要元素——氧(O)、碳(C)、氢(H)、氮(N)——构成了生物体约96%的质量。钙(Ca)、磷(P)、钾(K)、硫(S)等元素占据剩余质量的大部分。还有一些微量元素,虽然需求量极少,但作用关键。
微量元素虽然含量少,但功能重要。比如铁(Fe)是血红蛋白的重要组成部分,碘(I)是甲状腺激素合成的关键元素。
让我们通过一个表格来了解人体内各元素的分布情况:
从这个数据可以看出,水(H₂O)占人体成分的绝大部分,这解释了为什么氧元素含量如此之高。
有毒元素与环境适应
并非所有自然元素都对生物有益。砷(As)等重金属对人体有害,可能导致多种疾病甚至致死。在中国一些地区,如内蒙古、新疆等地的地下水中天然含有砷,长期饮用这样的水源会对健康造成严重威胁。目前这些地区正在实施改水工程,降低水中砷含量。
有些植物已经进化出了对有毒金属的耐受性,比如在云南东川铜矿区生长的特殊植物群落,它们能够在含有高浓度铜、铅等重金属的土壤中正常生存。
原子
原子的基本结构
每种元素都由特定类型的原子组成,原子是保持元素性质的最小单位。原子极其微小——大约需要一百万个原子才能排满这个句号的宽度。
原子由更小的亚原子粒子构成:质子、中子和电子。质子带正电荷,电子带负电荷,中子不带电。质子和中子紧密聚集在原子核中,而电子在核外高速运动,形成电子云。
原子序数和质量数
原子核中质子的数目称为原子序数,它决定了元素的性质。比如氦(He)的原子序数为2,意味着每个氦原子核内都有2个质子。在电中性的原子中,质子数等于电子数。
质量数是原子核中质子和中子的总数。通过质量数减去原子序数,就能得出中子数。
以钠原子为例:
- 质量数 = 质子数 + 中子数 = 23
- 原子序数 = 质子数 = 11
- 中子数 = 23 - 11 = 12
同位素及其应用
同一种元素的原子虽然质子数相同,但中子数可能不同,这样的原子称为同位素。碳元素有三种天然同位素:
同位素在科学研究和医学诊断中有重要应用。比如,中国科学院利用碳-14测定出河南舞阳贾湖遗址的年代约为9000年前,这项技术帮助我们了解了中华文明的悠久历史。
放射性同位素在医学诊断中发挥重要作用。北京协和医院等三甲医院常用PET-CT扫描技术,通过注射含有放射性标记物质的葡萄糖,观察其在体内的分布,从而诊断肿瘤等疾病。
电子的能级结构
电子壳层的概念
原子内的电子并不是毫无规则地围绕原子核运动,而是依据能量的高低分布在不同的电子壳层(或能级)中。这种分布方式可以用层层同心圆来类比:就像一栋高楼的住户只能住在某一具体楼层,不能随意浮在楼层之间一样,电子也只能“居住”在特定的能级上,不能处于能级之间的位置。
每一电子壳层离原子核的距离、能量都有所不同。最靠近原子核的称为第一壳层(K层),其能量最低,也最为稳定,只能容纳2个电子;第二壳层(L层)能量更高,最多能容纳8个电子;第三壳层(M层)则能容纳18个电子,依次类推。电子会优先填充最靠近原子核、能量最低的壳层,只有在内层被填满后,电子才会依次进入外层。例如,碳原子的电子排布为2-4,即第一壳层2个电子,第二壳层4个电子。
这种壳层结构不仅决定了原子的稳定性,也直接影响其化学反应能力。元素周期表的周期实际上就反映了电子壳层的逐层填充过程。
当能级升高时,电子需要吸收能量(如加热或吸收光),当能级降低时,电子会释放能量(如发光现象)。例如,霓虹灯中某些气体原子的电子吸收能量后跃迁到更高能级,再返回低能级时释放出特定波长的可见光,产生五彩斑斓的灯光。
价电子与化学性质
原子最外层电子壳层中的电子,称为“价电子”。价电子的数目直接决定了原子的化学性质及其与其他原子的结合方式。在化学反应中,主要发生变化的就是这些价电子,它们参与形成化学键,使原子之间结合成各种分子或离子。
具有相同价电子数的元素,往往具有相似的化学性质。例如,元素周期表中同一族的元素,如第七主族的卤素——氟(F)、氯(Cl)、溴(Br)、碘(I)等——都拥有7个价电子,它们都容易获得1个电子,形成带负电荷的离子(如F⁻、Cl⁻等),因此具有强烈的氧化性和极强的反应活性。又如,第一主族的碱金属——锂(Li)、钠(Na)、钾(K)等——最外层只有1个电子,极易失去,形成带正电的离子(如Na⁺),所以这些元素都极易与卤素反应生成盐类。
例如,氟(F)和氯(Cl)各有7个价电子,都很容易与钠(Na)结合:氟化钠(NaF)常用于牙膏中防蛀牙,氯化钠(NaCl)则是我们常见的食用盐。
当最外层电子壳层已经充分填满时(例如,氦[He]有2个,氖[Ne]有8个,氩[Ar]也有8个价电子),这些原子的化学性质就极为稳定,不容易与其他原子发生反应,因此它们被称为惰性气体或稀有气体。在自然界中,这类原子几乎总是以单原子的形式存在,很少形成化合物。例如,氖气和氩气广泛应用于照明和科研,其惰性确保了安全和稳定。
价电子理论不仅能解释单质、化合物的结构和性质,还为理解分子轨道、复杂分子的形成打下了基础。我们将在后续章节更深入地讨论电子结构与生命大分子的关系。
化学键
共价键的形成
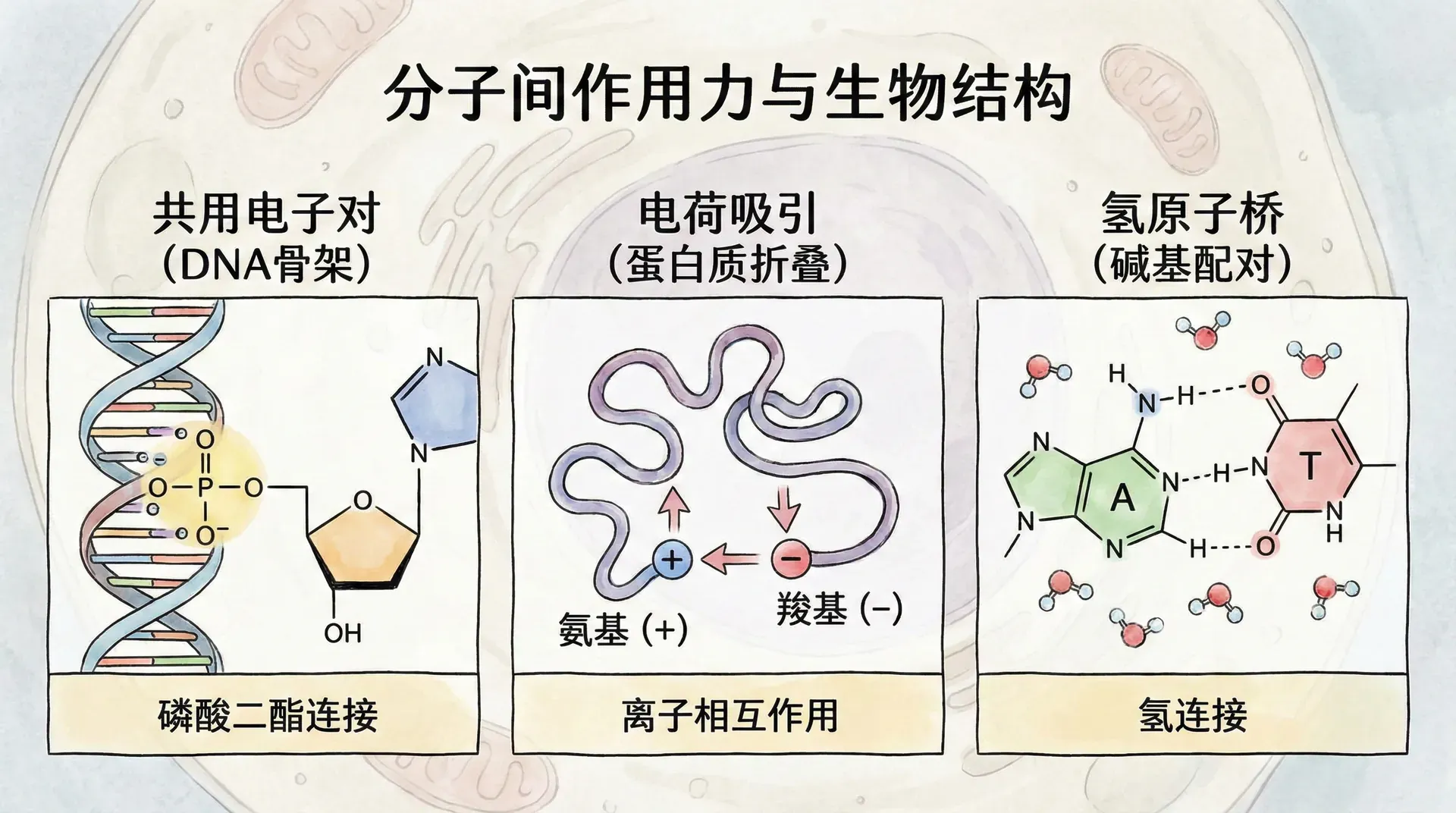
当两个原子通过共享价电子来完成各自的价电子壳层时,就形成了共价键。这就像两个人合作完成一项任务,各自贡献力量,最终达到共同目标。
以氢气分子(H₂)的形成为例:两个氢原子各有1个电子,通过共享这对电子,每个氢原子都获得了完整的第一电子壳层(2个电子)。
氢气分子的形成过程可以用如下示意表达:
-
起始状态:
- 两个氢原子(H)单独存在,各自有1个电子。
H + H
- 两个氢原子(H)单独存在,各自有1个电子。
-
靠近并共享电子:
- 两个原子彼此靠近,各自贡献1个电子,形成一对共享电子。
H · + ·H ⟶ H:H
- 两个原子彼此靠近,各自贡献1个电子,形成一对共享电子。
-
生成氢气分子(H₂):
- 共享电子对形成共价键,两原子共同拥有2个电子。
H―H - (每个氢原子都获得完整的第一层电子壳层)
- 共享电子对形成共价键,两原子共同拥有2个电子。
图示说明:两颗氢原子通过共享一对电子,形成稳固的氢气分子(H₂)。这是最简单的共价键形成过程。
氧原子有6个价电子,需要2个电子来填满价电子壳层。两个氧原子通过共享两对电子形成双键,构成氧气分子(O₂)。
极性共价键与非极性共价键
当两个相同元素的原子形成共价键时,电子被平等共享,形成非极性共价键,如氢气(H₂)和氧气(O₂)中的化学键。
但当不同元素的原子结合时,电负性较强的原子会更强烈地吸引共享电子,形成极性共价键。水分子(H₂O)就是典型例子:氧原子比氢原子更强烈地吸引电子,导致氧原子带部分负电荷(δ-),氢原子带部分正电荷(δ+)。
离子键的形成
当两个原子的电负性差异很大时,电负性强的原子会完全夺取另一个原子的价电子,形成离子键。
例如,食盐(NaCl)的形成,钠原子失去1个电子变成钠离子(Na⁺),氯原子得到1个电子变成氯离子(Cl⁻),两个带相反电荷的离子相互吸引形成离子键。
弱相互作用力
氢键
氢键是一种重要的弱相互作用力。虽然氢键的强度远不及共价键和离子键,但却在化学与生物系统中扮演了“掌控大局”的角色。其形成条件是:氢原子与电负性很强的原子(如O、N、F)形成共价键后,氢呈现部分正电荷,可以与邻近分子的高电负性原子之间发生静电吸引,从而形成氢键。
氢键显著影响分子的物理性质(如熔点、沸点、溶解性),并决定许多分子的三维结构。
常见能形成氢键的分子举例:
水分子中的氧与氢形成共价键,而不同水分子间可通过氢键连接,液态水中可形成“动态网络”——这正是水具有高沸点、较大的蒸发热和液态稳定性的根本原因。此外,氢键还广泛存在于DNA碱基配对、蛋白质α螺旋和β折叠等结构中,是生命大分子构建的“隐形搭桥”。
范德华力
范德华力是原子或分子间普遍存在的另一种弱相互作用力,即使是最简单的稀有气体或非极性分子,也能通过范德华力被吸引。其包括三类分力:
- 伦敦色散力(瞬时偶极—诱导偶极力,主要成分)
- 永久偶极—诱导偶极力
- 永久偶极—永久偶极力
比如在非极性分子中,由于电子云随机运动,会时刻生成短暂偶极,引起周围分子的电子云偏移,继而发生吸引。这就是“伦敦色散力”,也是范德华力的基础。
范德华力虽然远弱于化学键和氢键,但在生命和材料领域依然极其关键。例如:金属、稀有气体也能在低温下凝聚成液体,这是范德华力的功劳。再比如壁虎可以“爬墙走天花板”,其实是靠脚趾亿万个微绒毛与墙面通过大量微弱的范德华力协同产生巨大的附着力。
虽然称作“弱相互作用力”,但在调控物质物理性质、生物分子的组装和结构稳定上,却是不可或缺的小巨人。
分子形状与生物功能
分子几何学的重要性
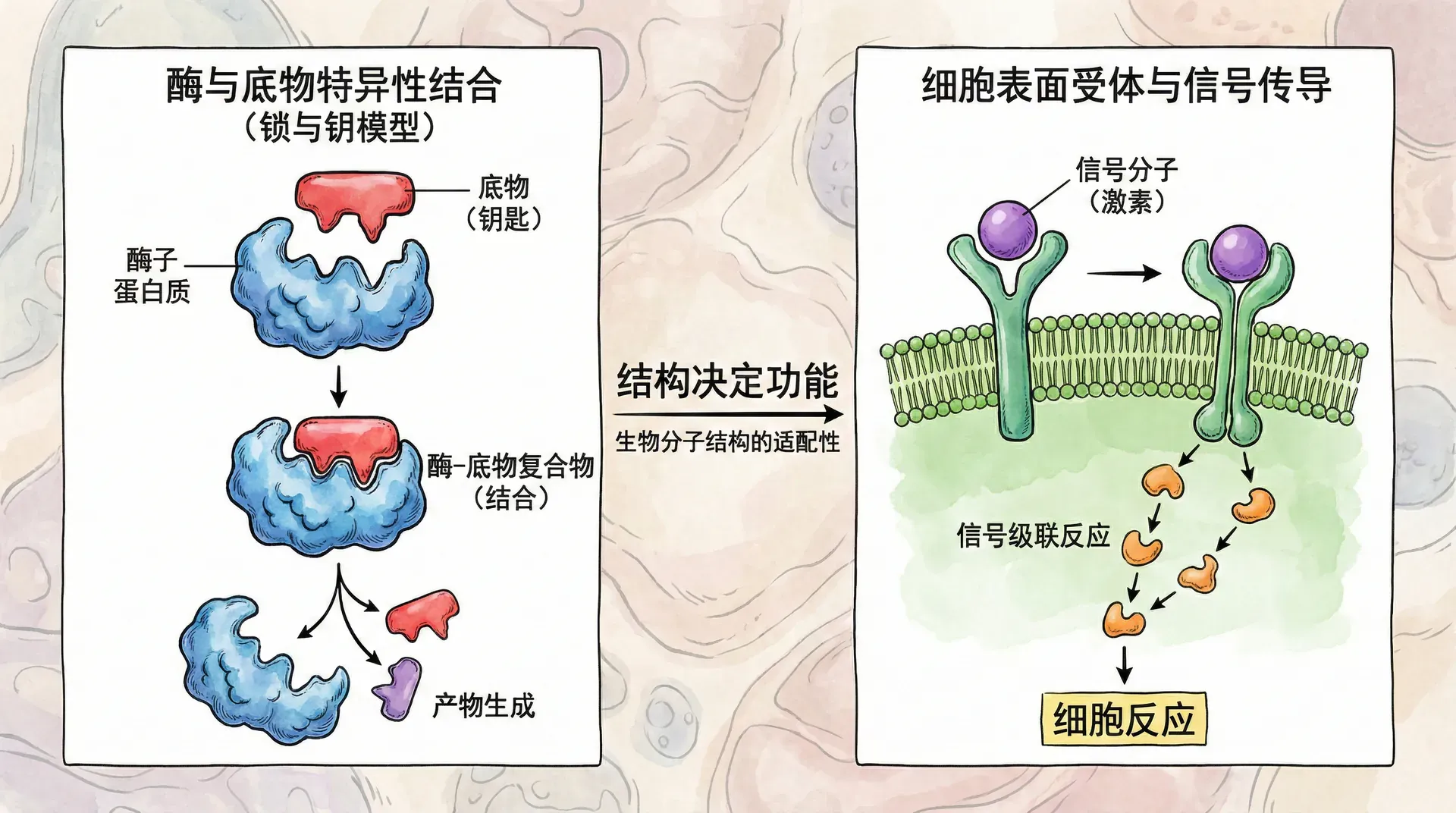
分子的三维结构对其在化学和生物体中的功能有决定性影响。如果钥匙和锁不匹配,就无法开门;同样,生物大分子间精准的“契合”保证了生命活动的正常进行。
分子的空间构型主要由原子的连接方式和空间排布决定,这决定着分子的溶解性、极性及其反应活性等物理化学性质。
常见小分子的空间结构举例:
例如,水分子形成V形结构,使其可通过极性作用力和氢键形成稳固网络,具有高沸点、优良溶解能力。甲烷为四面体、稳定且对称。氨、二氧化碳等几何结构差异,产生出完全不同的物质属性。
分子识别与药物作用
分子识别(如酶与底物、抗体与抗原、受体与信号分子)高度依赖分子形状之间的互补性,这被称为“锁和钥匙模型”或“诱导契合模型”。只有当分子的三维结构能够精准适配时,才会发生特定的生物学功能。
在药物设计中,分子的空间结构同样至关重要。药物分子需与靶标(如蛋白酶、受体蛋白)形成空间匹配,才能顺利结合并产生作用。例如,吗啡等阿片类药物结构酷似人体内啡肽,因此能与相同受体结合,达到镇痛的效果。
如果药物分子的结构出现微小差异,甚至仅仅是一个基团的变化,都可能导致无法结合靶点,药效下降甚至出现副作用。因此,现代药物化学利用分子建模和计算,预测分子的最佳空间构型,提升药物的靶向性和安全性。
吗啡等药物的止痛和成瘾机制高度依赖分子结构与内啡肽的“形状相似性”。正是这种结构的模仿,使得外源分子篡夺了本体分子的生理通路,产生了意外的生理和心理效应。
分子形状的微小差异,可能决定药物是“良方”还是“毒药”。研究显示,正是这些微小的结构变化,影响了与受体的结合能力,进而决定生理效应和可能产生的依赖性。
化学反应的本质
化学键的形成与断裂
化学反应的实质是化学键的断裂和形成,导致物质组成的改变。以水的形成为例:
在这个反应中,氢气分子中的H-H键和氧气分子中的O=O键被断开,同时形成了水分子中的O-H键。
化学反应前的物质称为反应物,反应后的物质称为生成物。虽然化学键发生了重新排列,但原子的种类和数量保持不变,遵循质量守恒定律。
能量变化与反应方向
化学反应往往伴随着能量的吸收或释放。燃烧反应会释放热能和光能,而植物的光合作用则需要吸收光能将二氧化碳和水转化为葡萄糖。
理解这些基本的化学原理为我们深入学习生物大分子的结构和功能奠定了重要基础。蛋白质的空间结构、DNA的双螺旋结构、细胞膜的磷脂双分子层——这些生物体系的精妙设计都建立在我们今天讨论的化学原理之上。