生命之源——水
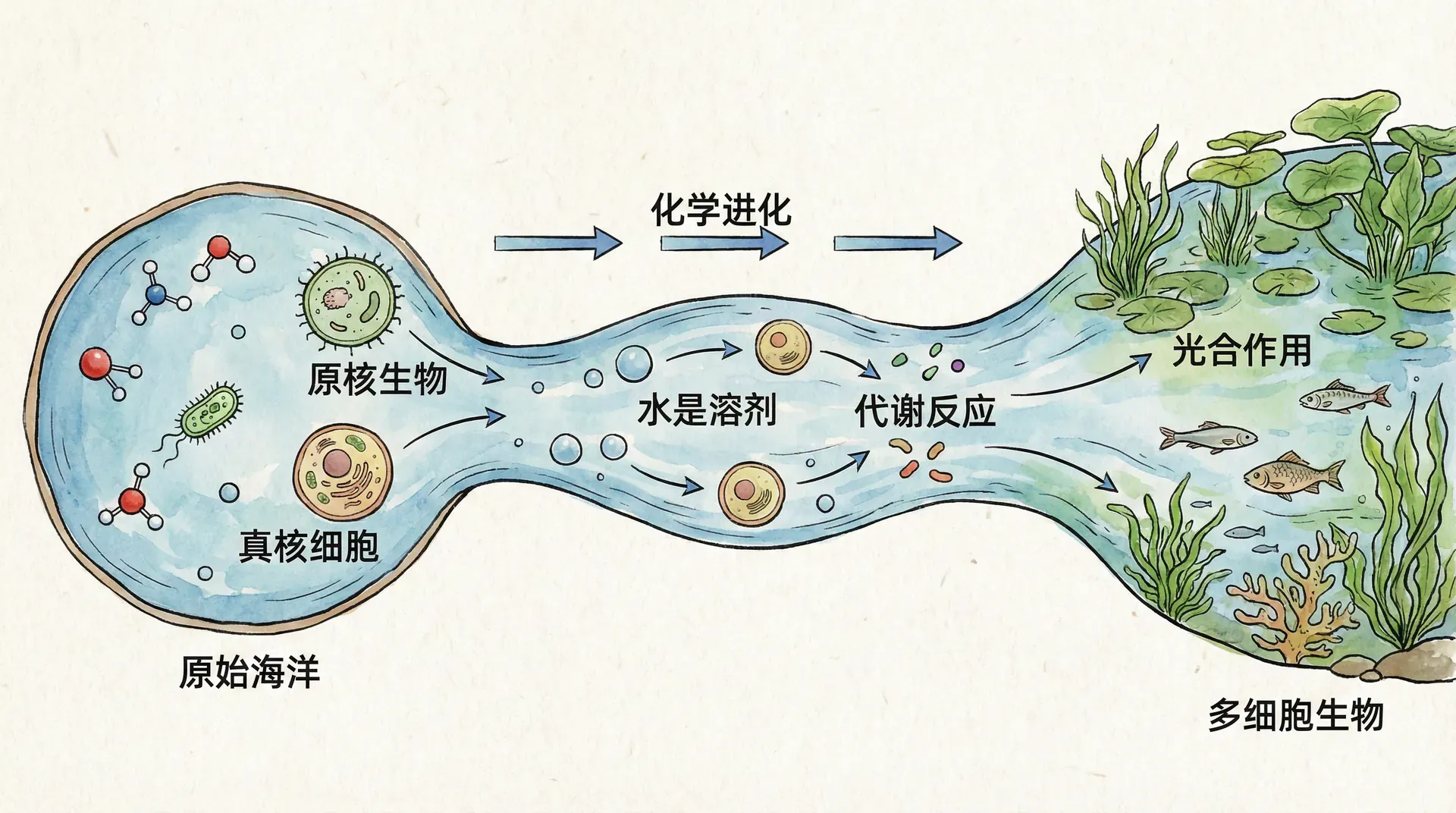
地球上的生命起源于水中,在那里演化了三十多亿年才逐渐登陆。水是我们所知道的地球生命存在的基础,也可能是其他星球生命存在的关键。我们熟悉的所有生物主要由水构成,并且生活在水占主导地位的环境中。
地球表面的四分之三被水覆盖。虽然其中大部分是液态水,但地球上的水还以固态(冰)和气态(水蒸气)形式存在。水是地球上唯一在自然环境中以物质三态同时存在的常见物质。更重要的是,水的固态形式能够浮在液态形式之上,这是水分子化学性质带来的独特现象。
随着全球气候变暖的加剧,冰与液态水的比例正在发生变化。在我国青藏高原,近年来冰川融化加速,影响着冰川周围、上方和下方的生物群落。在中国的长江源头,气温升高和冰层减少导致浮游植物(微小的水生光合作用生物)大量繁殖,这从卫星图像中可以清楚地看到江水中“浑浊”的现象。然而,依赖于高原冰雪环境的生物却面临生存威胁。例如,栖息在青海湖地区的某些鸟类种群因气候变暖和冰雪减少而数量下降。
水分子的极性共价键产生氢键
水对我们来说太熟悉了,以至于我们很容易忽视它的许多非凡特质。从分子层面来看,我们可以将水独特的行为追溯到其分子结构和相互作用。
单独研究水分子时,它的结构看起来非常简单。水分子呈宽V形,两个氢原子通过单共价键连接到氧原子上。由于氧的电负性比氢强,共价键中的电子更多地待在氧原子附近而不是氢原子附近,形成了极性共价键。这种电子分布不均和水的V形结构使水成为极性分子,意味着其整体电荷分布不均匀。在水分子中,氧原子带有两个部分负电荷区域(δ-),而每个氢原子带有部分正电荷(δ+)。
水的性质源于不同水分子间带相反电荷的原子之间的吸引力:一个分子的部分正电荷氢原子被附近分子的部分负电荷氧原子吸引。这样两个分子就通过氢键结合在一起。当水处于液态时,氢键非常脆弱,每个氢键的强度大约只有共价键的1/20。氢键形成、断裂并重新形成的频率很高,每个氢键只持续几万亿分之一秒,但分子会不断与一系列伙伴形成新的氢键。因此,在任何时刻,大多数水分子都与相邻分子形成氢键。水的非凡性质正是来源于这种氢键,它将水分子组织成更高层次的结构秩序。
水的四个新兴性质
我们将研究水的四个新兴性质,这些性质使地球成为适宜生命生存的环境:内聚行为、调节温度的能力、结冰时膨胀以及作为溶剂的多功能性。
水分子的内聚性
由于氢键的存在,水分子彼此紧密结合。虽然液态水中分子的排列在不断变化,但在任何给定时刻,许多分子都通过多个氢键相连。这些连接使水比大多数其他液体更有结构性。氢键共同将这种物质结合在一起,这种现象称为内聚性。
氢键导致的内聚性有助于植物中水和溶解营养物质的向上运输对抗重力。水从根部到达叶子需要通过水分输送细胞网络。当水从叶子蒸发时,氢键使离开叶脉的水分子拖拽下面的分子,向上的拉力通过水分输送细胞一直传递到根部。附着力——一种物质对另一种物质的粘附——也发挥着重要作用。水通过氢键对细胞壁分子的附着有助于抵抗向下的重力。
我国的银杏树,高达40米的古银杏能够将水从根部输送到树冠,这正是依靠水分子间的内聚性和与植物组织间的附着力实现的。
与内聚性相关的是表面张力,它是衡量拉伸或破坏液体表面难易程度的指标。在水与空气的界面处,水分子有序排列,彼此以及与下方的水形成氢键,但不与上方的空气形成氢键。这种不对称性赋予水异常高的表面张力,使其表现得好像覆盖了一层无形的薄膜。你可以通过轻微溢满一个水杯来观察水的表面张力现象——水会高于杯沿。一些昆虫如水黾正是利用水的表面张力在池塘表面行走而不会破坏水面。
水对温度的调节

水通过吸收较暖空气的热量和向较冷空气释放储存的热量来调节气温。水之所以是有效的热库,是因为它能够吸收或释放相对大量的热量而自身温度只发生轻微变化。要理解水的这种能力,我们首先需要了解温度和热量的概念。
温度与热量
任何运动的物体都具有动能——运动的能量。原子和分子具有动能是因为它们总是在运动,尽管不一定朝特定方向运动。分子运动越快,动能就越大。与原子或分子随机运动相关的动能称为热能。
热能与温度相关,但两者不是同一回事。温度代表物质中分子的平均动能,与体积无关;而物质的热能反映总动能,因此取决于物质的体积。
当我们用电热水壶加热水时,分子的平均速度增加,温度计记录这种变化为液体温度的上升。在这种情况下,总热能也增加。需要注意的是,虽然一壶热水的温度比游泳池的水温高得多,但游泳池由于体积大得多而含有更多的热能。
水的高比热容
水稳定温度的能力源于其相对较高的比热容。物质的比热容定义为使1克该物质改变1°C所需吸收或失去的热量。我们已经知道水的比热容,因为我们定义了卡路里为使1克水温度改变1°C所需的热量。因此,水的比热容为1卡路里每克每摄氏度,缩写为1 cal/(g·°C)。与大多数其他物质相比,水的比热容异常高。
以下表格展示了一些常见物质的比热容对比:
由于水相对于其他材料具有高比热容,当吸收或失去给定热量时,水的温度变化比其他液体小。这就解释了为什么当锅中的水仍然温热时,触摸炉子上铁锅的侧面会烫伤手指——水的比热容是铁的十倍。换句话说,相同的热量使1克铁升温的速度比1克水快得多。
我们可以将水的高比热容,就像它的许多其他性质一样,追溯到氢键。必须吸收热量来断裂氢键;同样,当氢键形成时会释放热量。一卡路里的热量只会引起水温度的相对较小变化,因为大部分热量被用于破坏氢键,然后水分子才能开始更快地运动。
水的高比热容对地球生命有什么意义呢?大面积水体能够在白天和夏季吸收并储存太阳的大量热量,而自身温度只升高几度。在夜间和冬季,逐渐冷却的水能够温暖空气。这种水的能力有助于调节沿海地区的气温。以我国东南沿海城市为例,由于靠近海洋,这些城市的温度变化比内陆城市小得多。水的高比热容还有助于稳定海洋温度,为海洋生物创造有利环境。
蒸发冷却
任何液体的分子都因为相互吸引而紧密聚集。运动足够快而能够克服这些吸引力的分子可以脱离液体进入空气中成为气体(蒸汽)。这种从液体到气体的转变称为汽化或蒸发。
汽化热是1克液体转化为气态所必须吸收的热量。由于与水具有高比热容相同的原因,水相对于大多数其他液体也具有高汽化热。在25°C时蒸发1克水大约需要580卡路里的热量——几乎是蒸发1克酒精或氨气所需热量的两倍。
水的高汽化热在各个层面都有影响。在全球尺度上,它有助于调节地球气候。热带海洋吸收的大量太阳热量在表面水蒸发过程中被消耗。然后,当潮湿的热带空气向两极循环时,它凝结形成雨水并释放热量。
在生物体层面,水的高汽化热解释了蒸汽烧伤的严重性。这些烧伤是由蒸汽在皮肤上凝结成液体时释放的热能造成的。
当液体蒸发时,剩余液体的表面会冷却(温度降低)。这种蒸发冷却的发生是因为"最热"的分子——那些具有最大动能的分子——最有可能以气体形式离开。这就像一所学校的100名跑得最快的学生转到另一所学校;剩余学生的平均速度就会下降。
水的蒸发冷却有助于湖泊和池塘温度的稳定,也为陆地生物提供了防止过热的机制。例如,植物叶片中水分的蒸发有助于保持叶组织在阳光下不会过热。人体皮肤汗液的蒸发散发体热,有助于在炎热天气或剧烈活动产生多余热量时防止过热。
在中国夏季的城市中,我们可以看到蒸发冷却效应的实际数据:
冰浮在液体水面上
水是少数固态密度小于液态的物质之一。换句话说,冰浮在液体水上。当其他材料凝固时会收缩变得更密,而水则膨胀。这种异常行为的原因仍然是氢键。
在液体水中,每个水分子平均与大约3.4个其他水分子形成氢键。然而,在冰中,每个水分子与四个伙伴形成氢键,产生了三维晶体。晶体结构必须保持氢键的角度,这迫使分子间距比液体水中的平均距离更大。
这种看似微不足道的性质——冰浮在水面上——对生命产生了深远影响。如果冰沉到底部,那么所有的水体最终都会完全结冰,使生命不可能存在。相反,当深湖开始结冰时,表面的冰形成一层绝缘层,保护下面的液体水不结冰,使鱼类和其他水生生物能够在冰层下生存。
以我国东北地区的冬季湖泊为例,松花江等河流表面结冰后,下方的液态水为鱼类提供了生存空间,这种现象保护了水生生态系统。
生命的溶剂
如果将一块糖放入一杯水中稍加搅拌,糖就会溶解。杯子里就会含有糖和水的均匀混合物;溶解糖的浓度在整个混合物中都是相同的。两种或多种物质完全均匀混合的液体称为溶液。溶液的溶解剂是溶剂,被溶解的物质是溶质。在这种情况下,水是溶剂,糖是溶质。水溶液是溶质溶解在水中的溶液;水是溶剂。
水是非常多功能的溶剂,我们可以将这种性质追溯到水分子的极性。假设将一勺食盐(离子化合物氯化钠NaCl)放入水中。在每个盐晶体的表面,钠离子和氯离子暴露在溶剂中。这些离子和水分子的区域由于电荷相反而相互吸引。水分子的氧原子有部分负电荷区域,被钠阳离子吸引。氢区域部分带正电,被氯阴离子吸引。结果,水分子包围了单个钠离子和氯离子,将它们分离并屏蔽。围绕每个溶解离子的水分子球称为水化壳。
亲水和疏水物质
任何与水有亲和力的物质都被称为亲水性(来自希腊语hydro,水,和philos,喜爱)。在某些情况下,物质可以是亲水性的而实际上不溶解。例如,细胞中的一些分子太大而不溶解。另一个不溶解的亲水性物质的例子是棉花。棉花由纤维素的巨大分子组成,这种化合物具有许多部分正电荷和部分负电荷区域,可以与水形成氢键。水附着在纤维素纤维上。因此,棉毛巾能很好地擦干身体,但在洗衣机中不会溶解。
当然,也有一些物质与水没有亲和力。非离子性和非极性的物质(或其他不能形成氢键的物质)实际上似乎排斥水;这些物质被称为疏水性(来自希腊语phobos,恐惧)。厨房里的一个例子是植物油,正如你所知,它不能与醋等水基物质稳定混合。
水溶液中溶质浓度
生物体内的大多数化学反应都涉及溶解在水中的溶质。要理解这些反应,我们必须知道涉及多少原子和分子,并计算水溶液中溶质的浓度(溶液体积中溶质分子的数量)。
在进行实验时,我们使用质量来计算分子数量。我们必须首先计算分子质量,即分子中所有原子质量的总和。例如,让我们通过将原子数乘以每个元素的原子质量来计算蔗糖(C₁₂H₂₂O₁₁)的分子质量。以道尔顿为单位的整数,碳原子的质量是12,氢原子的质量是1,氧原子的质量是16。因此,蔗糖的分子质量为(12×12)+(22×1)+(11×16)=342道尔顿。
酸性和碱性条件影响生物

有时,参与两个水分子间氢键的氢原子会从一个分子转移到另一个分子。当这种情况发生时,氢原子留下其电子,实际转移的是氢离子(H⁺),一个电荷为1+的质子。失去质子的水分子现在是氢氧离子(OH⁻),电荷为1-。质子与另一个水分子结合,使该分子成为水合氢离子(H₃O⁺)。
这是一个可逆反应,当水分子解离的速度与它们从H⁺和OH⁻重新形成的速度相同时,达到动态平衡状态。在平衡点,水分子的浓度大大超过H⁺和OH⁻的浓度。在纯水中,每554万个水分子中只有一个解离;因此,纯水中H⁺和OH⁻的浓度都是10⁻⁷M(在25°C时)。
酸和碱
什么会导致水溶液中H⁺和OH⁻浓度失衡呢?当酸溶解在水中时,它们向溶液中额外贡献H⁺。酸是增加溶液氢离子浓度的物质。例如,当盐酸(HCl)加入水中时,氢离子从氯离子中解离出来:
这种H⁺来源(水的解离是另一种来源)导致酸性溶液——H⁺多于OH⁻的溶液。
减少溶液氢离子浓度的物质称为碱。一些碱通过直接接受氢离子来减少H⁺浓度。例如,氨(NH₃)在氮的价电子壳中有未共享电子对,当它从溶液中吸引氢离子时充当碱,形成铵离子(NH₄⁺):
pH标度
在25°C的任何水溶液中,H⁺和OH⁻浓度的乘积都是常数10⁻¹⁴。这可以写成:
因为H⁺和OH⁻的浓度可以相差100万亿倍或更多,科学家们开发了一种比用摩尔每升更方便的方式来表达这种变化。pH标度通过使用对数来压缩H⁺和OH⁻浓度的范围。
溶液的pH定义为氢离子浓度的负对数(以10为底):
对于中性水溶液,[H⁺]为10⁻⁷M,因此:
注意,随着H⁺浓度增加,pH下降。同样注意,虽然pH标度基于H⁺浓度,但它也暗示OH⁻浓度。
25°C中性水溶液的pH为7,是pH标度的中点。pH值小于7表示酸性溶液;数字越小,溶液越酸。碱性溶液的pH高于7。大多数生物液体,如血液和唾液,都在pH 6-8范围内。
以下是一些常见食品和日用品的pH值:
缓冲液
大多数活细胞的内部pH接近7。即使pH的轻微变化也可能有害,因为细胞的化学过程对氢离子和氢氧离子的浓度非常敏感。人体血液的pH非常接近7.4,略偏碱性。如果血液pH降至7或升至7.8,人就无法存活超过几分钟。
缓冲液的存在使生物液体能够在加入酸或碱时保持相对恒定的pH。缓冲液是一种最小化溶液中H⁺和OH⁻浓度变化的物质。它通过在氢离子过量时从溶液中接受氢离子,在氢离子不足时向溶液中提供氢离子来实现这一点。大多数缓冲溶液含有弱酸及其相应的碱,它们与氢离子可逆结合。
人体血液和许多其他生物溶液中有几种缓冲液有助于pH稳定。其中之一是碳酸(H₂CO₃),当CO₂与血浆中的水反应时形成。碳酸解离产生碳酸氢根离子(HCO₃⁻)和氢离子(H⁺):
碳酸和碳酸氢根之间的化学平衡起到pH调节器的作用,反应会根据溶液中其他过程加入或除去氢离子而向左或右移动。
海洋酸化
人类活动对水质构成的众多威胁中,化石燃料燃烧释放CO₂到大气中是其中之一。大气CO₂水平的上升导致了全球变暖和气候变化的其他方面。此外,人类产生的CO₂约有25%被海洋吸收。尽管海洋中的水量巨大,科学家们担心吸收如此多的CO₂会损害海洋生态系统。
当CO₂溶解在海水中时,它与水反应形成碳酸,从而降低海洋pH。这个过程被称为海洋酸化,改变了海洋中生命条件的微妙平衡。基于对数千年来冰中气泡中CO₂水平的测量,科学家计算出现在海洋的pH比过去42万年中任何时候都低0.1个pH单位。最近的研究预测,到本世纪末,pH还将下降0.3-0.5个单位。
在中国的近海,我们可以看到海洋酸化的影响:
随着海水酸化,额外的氢离子与碳酸根离子(CO₃²⁻)结合形成碳酸氢根离子(HCO₃⁻),从而减少碳酸根离子浓度。科学家预测,到2100年,海洋酸化将使碳酸根离子浓度下降40%。这非常令人担忧,因为碳酸根离子是钙化所必需的——许多海洋生物(包括造礁珊瑚和建造贝壳的动物)生产碳酸钙(CaCO₃)的过程。
海洋酸化对中国沿海的珊瑚礁生态系统造成严重威胁。南海的珊瑚礁是海洋生物多样性的重要栖息地,珊瑚礁生态系统的消失将是生物多样性的巨大损失。
如果我们对地球水资源未来质量抱有乐观态度,那是因为我们在了解海洋、湖泊和河流中微妙的化学平衡方面取得了进展。只有通过像你们这样关心环境质量的明智人士的行动,才能继续取得进步。这需要理解水在环境持续适宜地球生命方面所起的关键作用。
总结
水分子的独特结构决定了它的四个关键性质:强烈的内聚性、卓越的温度调节能力、固态水(冰)的密度小于液态水,以及出色的溶解能力。这些性质协同作用,使地球成为生命赖以生存的宜居星球。
-
水的内聚性源于水分子之间的氢键,使水具有较高的表面张力。这不仅支持了植物通过蒸腾作用将水由根部运输到叶片的高处,也是许多小型生物能够在水面“行走”的原因。
-
水对温度变化的缓冲能力体现在其高比热容、汽化热和熔化热——这帮助生物体和地球表面气候避免剧烈的温度变化。例如,海洋储存和释放的热量调节全球气候,人体通过汗液蒸发保持恒定的体温。
-
水的固态密度小于液态,使得冰能够漂浮于水面。这一特性是湖泊和海洋在寒冷季节不致完全结冰,保护了水体下方的生物,维持了生态系统的稳定。
-
水能够溶解大量极性和部分非极性物质,被称为“通用溶剂”。细胞内外的许多生化反应都在水溶液中进行,水为营养物质、离子及废物的运输提供了理想介质。
值得强调的是,水所有这些特殊性质的根源是分子间氢键的存在。氢键不仅维持了水的液态结构,也决定了其物理、化学性质。只有深刻理解水的性质和其在环境系统中的角色,我们才能更好地认识生命现象、分析生物化学过程,并采取有效措施保护生态环境、水资源以及全球气候,为人类和地球的可持续未来做出贡献。