变构效应
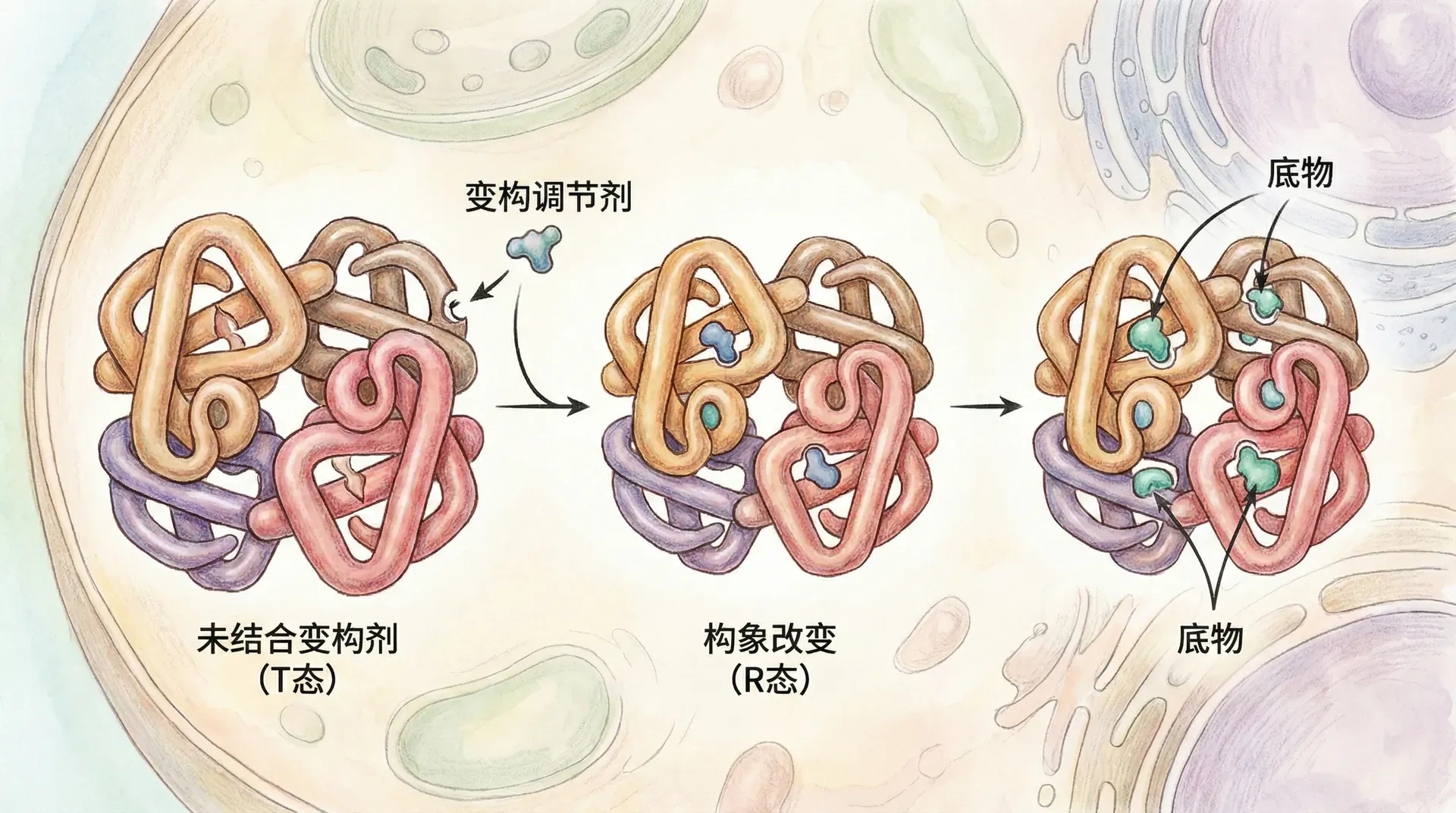
在生命体内,分子不断接收并“读取”环境和细胞内部发出的各种信号,如温度变化、pH波动或代谢产物的积累,这些信号常常促使分子快速切换不同的功能状态。让分子能够像开关一样灵活“上线”或“下线”各类生物活动的关键机制,就是变构效应(Allosteric Effect)。
变构效应本质上是生物分子通过形态(构象)的微小调整,实现对自身活性的精准控制。这一机制为复杂生理活动的动态调节提供了可能。例如,从低地到高原时,血红蛋白通过变构改变氧亲和力以适应环境;日常生活中,如闻到食物香味时唾液腺迅速分泌,同样也依赖多级信号网络中的变构调控。这些丝滑而高效的反应,背后均有变构机制的参与,为生物体提供对环境变化的灵敏感知与迅速适应。
变构效应即分子结构发生构象变化进而调节其活性,使生物系统在应对各种外部和内部刺激时,具备快速、精准的响应能力。
血红蛋白的氧合作用是变构效应的经典案例,但这一机制远远超出了单一实例:酶活性的调节、受体信号转导、离子通道的门控及蛋白质复合体的动态组装等,都是通过变构效应实现高效调控。正因有了这种机制,生命系统才能精准协同、灵活应对各种内外挑战。
独立结合与超敏感性的对比
在进一步理解变构调控前,我们先来比较两种不同的分子结合模式:独立结合和超敏感性结合。
独立结合事件的特征
当我们讨论分子结合现象时,最简单的情形就是独立结合。在这种系统里,每个结合位点的行为都是独立的,互不影响。无论一个大分子有多少个结合位点,某个位点是否已结合配体,都不会影响其他位点结合配体的能力。
举个形象的比喻:一个茶壶有四个倒茶口,每个茶口都可以独立地控制茶水的流出。无论其他茶口是否在倒茶,每个茶口的流量都保持不变。这就类似于独立结合的场景——没有彼此之间的协同或抑制作用。
在独立结合系统中,饱和度(θ)与配体浓度([L])之间遵循简单的双曲线/迈克利斯-门腾关系式:
其中 θ 表示所有结合位点的饱和比例,[L] 表示配体浓度,Kd 表示解离常数。下图为独立结合和协同结合的比较,横坐标为相对 Kd 的配体浓度,纵坐标为结合位点的饱和度。
这种情况下,随着配体浓度的线性增加,结合位点的饱和度也平稳地、渐进地增加。没有突变性的“开关”过程,而是类似渐变的灯光调节。
超敏感性系统的特点
与独立结合截然不同,超敏感性系统具备一个关键特征:它们能在极窄的配体浓度区间内,实现“关”到“开”的剧烈转换。这种特性让超敏感性系统在信号开关与阈值响应方面表现出色。在日常生活中,家里的电灯开关,只需要轻轻一按,灯光就会从完全关闭瞬间变为最亮,而不是缓慢渐亮。
在分子机制层面,这种现象往往与多个结合位点之间的协同作用有关——一种结合事件会显著影响其他位点结合的概率。例如,血红蛋白携氧时,第一个氧结合上去后会使剩余的结合位点更容易再结合氧气,从而加速整个过程,实现“雪崩”式的转变。
独立结合系统需要约100倍的浓度变化才能使饱和度从10%提升到90%,而超敏感性系统可能仅需3-5倍的浓度变化就能完成同样的转换。这意味着后者能更灵敏地充当生物体的“开关”装置,对于信号的分辨和响应都更为精准高效。
这种特性对于生命体来说具有至关重要的意义。例如,在神经信号传递、细胞周期调控、代谢途径酶的开关等场景中,只有“急剧”且“可靠”的转换,才能保证系统反应的有效性和安全性。下表总结了两种结合模式的主要差异,便于直观理解:
血红蛋白的协同氧结合
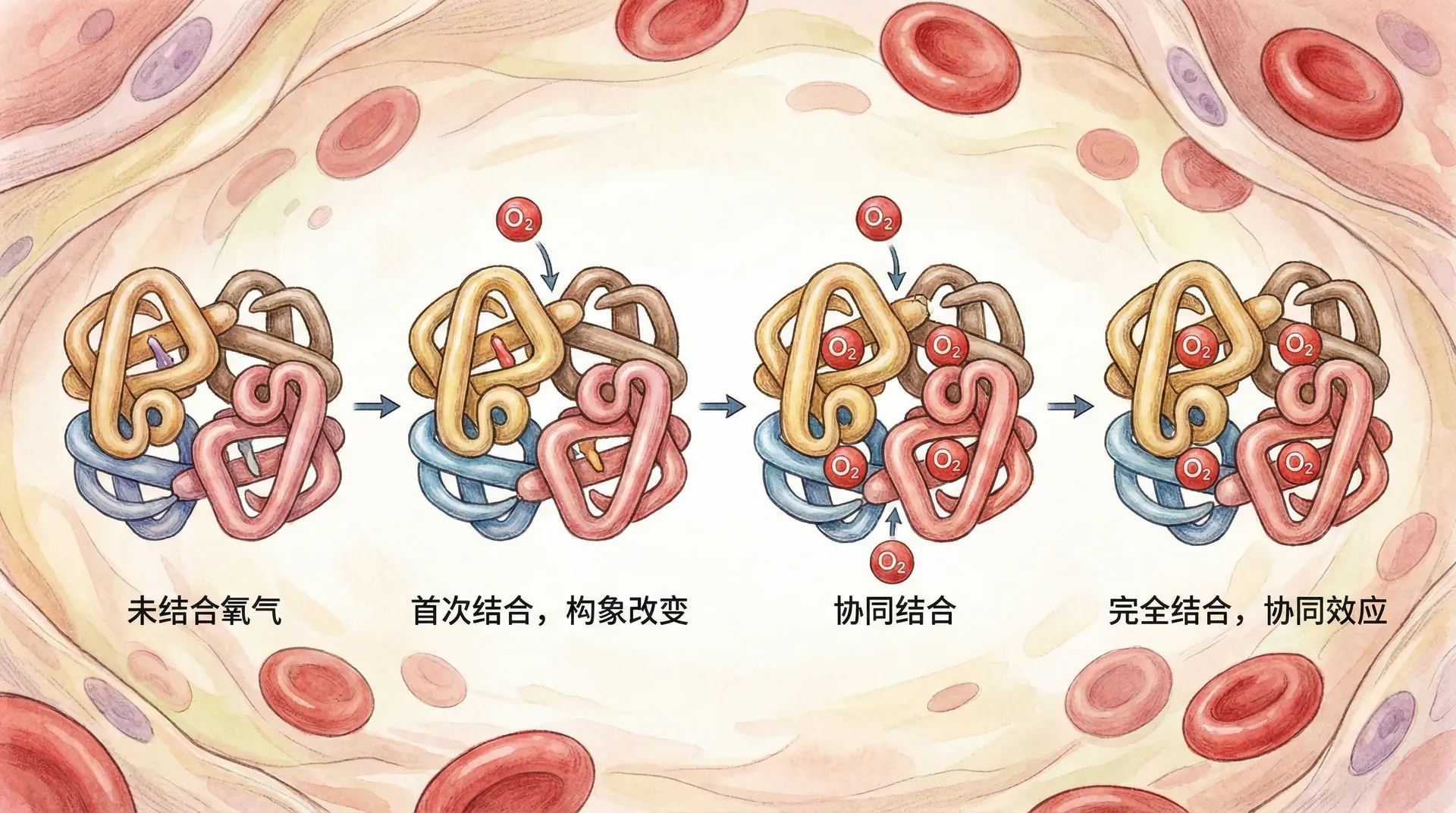
血红蛋白的结构特点
血红蛋白是研究变构效应和协同作用最经典的范例,也是呼吸生理不可或缺的核心分子。它由两个α亚基和两个β亚基组成四聚体,每个亚基都带有一个血红素基团——也就是为氧分子“量身定制”的座位。形象来说,血红蛋白就像一辆四座轿车:第一个氧分子“登车”后,剩下的座位就会变得更加“欢迎”新乘客,后续氧分子的结合概率显著提升,这就是协同作用的经典体现。
正因为其四聚体结构,血红蛋白分子的结合动力学远比单亚基蛋白(如肌红蛋白)复杂,实现了高度可调控和对不同环境的灵敏适应。这种精妙的分子机制,为生命活动中的氧气运输和供需平衡提供了基础。
T态和R态的转换机制
血红蛋白可以游走在两种主要构象状态之间:
T态(紧张态,Tense state):此时血红蛋白的氧亲和力较低,亚基之间形成大量非共价作用,整体结构比较紧凑,好比一只紧攥的拳头。在没有或者只结合了少量氧分子时,血红蛋白偏向于T态,难以与更多氧结合。
R态(松弛态,Relaxed state):与T态相反,R态下的血红蛋白分子氧亲和力显著提升。亚基间构象变松动,空隙增大,整体变得更像张开的手掌。在氧分子逐一结合后,血红蛋白分子的构象会逐步从T态向R态转变,从而促使剩余的结合位点更容易抓住氧分子。
这种T态与R态的动态平衡,使得血红蛋白对外界氧分压变化有极其灵敏的响应——低氧环境下促释氧,高氧环境下促结合。分别以“紧攥拳头与松开手掌”来比喻血红蛋白的两种状态,将分子层面的微妙变构与宏观生理功能紧密关联起来。
此外,历史上著名的Perutz等结构生物学家通过X射线结构测定揭示了这两种状态在空间构象上的显著区别,并提出了两态模型(Monod-Wyman-Changeux, MWC模型),极大推动了我们对协同效应的分子机制理解。
上图展示了血红蛋白与肌红蛋白结合氧分子的曲线。可以看到,血红蛋白的饱和度曲线为典型的S形(sigmoidal),这种非线性陡变正是协同效应的体现。而单亚基、无协同的肌红蛋白则呈现标准的双曲线。血红蛋白的协同机制保证了它在肺部高氧环境下可迅速装载氧气(P50附近即可有高饱和度),但进入低氧的组织环境后,其饱和度大幅下降,从而高效释放氧气,实现“精准定点投放”。这一特性保证了人体对氧供需求的高度适应性。
科学地说,血红蛋白的Hill系数约为2.8,显著高于1(完全无协同时为1),这从定量上反映了其协同结合的特性——越高的Hill系数代表越陡的转变、越灵敏的响应。
BPG和pH对血红蛋白的调节
单靠协同作用已经足够高明,但自然界的系统总是力求极致。血红蛋白的氧亲和力还会受到体内多种因素动态调节,尤以2,3-二磷酸甘油酸(BPG)和pH(即Bohr效应)最为关键。
BPG的作用机制: BPG是红细胞内独有的小分子,可优先结合血红蛋白的T态,进一步稳定其低氧亲和力状态。这样,血红蛋白就能在氧分压较低的组织环境下更容易放手释放氧气。例如,人剧烈运动或长期身处高原时,BPG浓度升高,使血红蛋白更偏向T态,对氧的亲和力下降,促进氧气下车被组织吸收。这种调节机制对于适应高原、运动等特殊环境至关重要。值得一提的是,新生儿的血红蛋白BPG亲和力较低,这有助于胎儿从母体那里更有效地“争抢”氧气。
pH效应(Bohr效应): 组织代谢产生的二氧化碳、乳酸等副产物会导致局部pH降低(酸性增强)。pH降低稳定血红蛋白的T态,使其亲和力下降、氧气更易释放。正所谓“哪里最缺氧,哪里pH就最低,哪里就最容易有氧气下车”。在剧烈运动的肌肉组织or快速消耗能量的脏器,Bohr效应尤为明显。这种机制通过微型负反馈回路,进一步提升氧运输的智能化和精准性。
为了帮助理解,下方总结如下:
除上述因素外,温度升高、某些离子(如Cl⁻)也可进一步调节血红蛋白的亲和力。由此可见,血红蛋白的氧运输功能是多因子协作、精准调控的最优范例。这不仅仅是生物化学的一节经典范例,更是生命工程设计的“教科书级案例”!
变构效应的进化意义
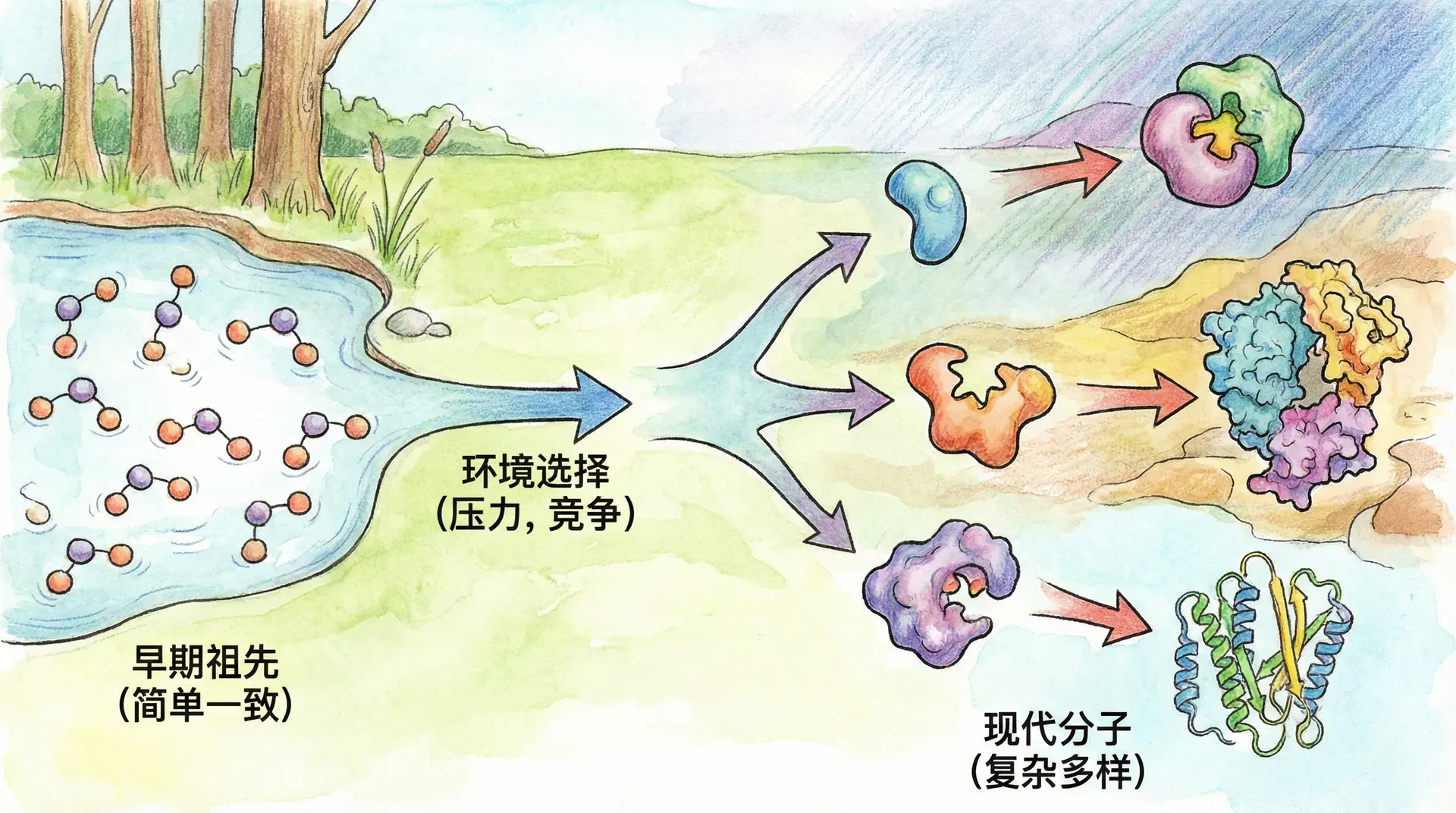
进化压力推动下的分子优化与多样性
变构效应并非偶发现象,而是生物长期进化和自然选择下保留下来的高效分子策略。为应对环境的多样变化,生物体通过变构机制获得了更灵活和高效的调节能力。这种机制广泛出现在许多关键生命活动中,显著提升了生物体的适应性与生存能力。
以血红蛋白和肌红蛋白为例:如果血红蛋白像肌红蛋白一样单一、独立地结合氧分子,其载氧和释氧效率将无法满足剧烈运动或缺氧时对氧气的巨大需求。正是由于同源亚基间的协同变构,血红蛋白才能在肺部高效“装载”氧气,在组织中迅速“释放”,满足高峰-低谷式的氧气运输需求。类似于普通货车与“智能货车”的对比——后者在装卸货物时可根据环境高效切换,更能应对复杂多变的运输场景。
总的来看,变构机制让分子具备了:
许多生物分子还进一步进化出多个变构调控位点,在面对多重信号干扰(如营养变化、毒素、极端环境)时能做出更加优选的响应,极大提升了生存适应力。
生命进化过程中,不同生态位的生物发展出独特的变构调节方式。例如,深海鱼类的血红蛋白对压力和pH高度敏感,适应了极端的环境;高原动物如藏羚羊则借助变构机制进化出更高的氧亲和力,使其在稀薄空气中也能高效运输氧气。极地微生物、嗜盐微生物等则借助变构调节保证在极端温度或盐度下的酶促反应正常进行。这些都充分展示了变构效应为生命提供的高度适应弹性和多样性。
需要注意的是,变构机制提升了调节精度和灵活性,也增加了系统复杂度。复杂调控网络在极端压力下可能出现“不稳定性”或“灾变响应”,如突变导致调节功能损失或疾病。因此,无论是分子进化还是工程应用,都要兼顾调节精密度与系统稳健性,避免“过于精妙”的自我失控。
总结
变构效应不仅仅是一个分子机制,更是生物系统在进化过程中优化信息处理和响应效率的通用策略。从血红蛋白的协同氧结合到酶的多层级调控,从信号分子的放大效应到复杂基因表达网络的灵活切换,变构机制几乎渗透在所有关键生命活动中,贯穿微观(分子)、中观(细胞)、宏观(个体)多个层次。
对于人类而言,理解变构效应的原理有着深远意义,它帮助我们:
- 解释生命过程的精妙调控和适应能力
- 揭示许多疾病(如镰刀型贫血、酶缺陷病等)背后的分子本质
- 指导新一代药物的精准设计(如变构调节剂、共价药物等)
- 启发生物技术工程对复杂网络的优化和重构
随着结构生物学、单分子动力学、人工智能辅助分子模拟等前沿技术的快速发展,我们对于变构机制的时空细节认识将日臻完善。这不仅能提升对健康和疾病的干预水平,也有望推动人工智能、生物合成等领域的跨界突破。未来,变构效应的研究将继续在生命科学、医学、工程等领域焕发出无限活力,成为解锁生命奥秘、加速技术创新的关键钥匙。