现代基因科学与生物技术
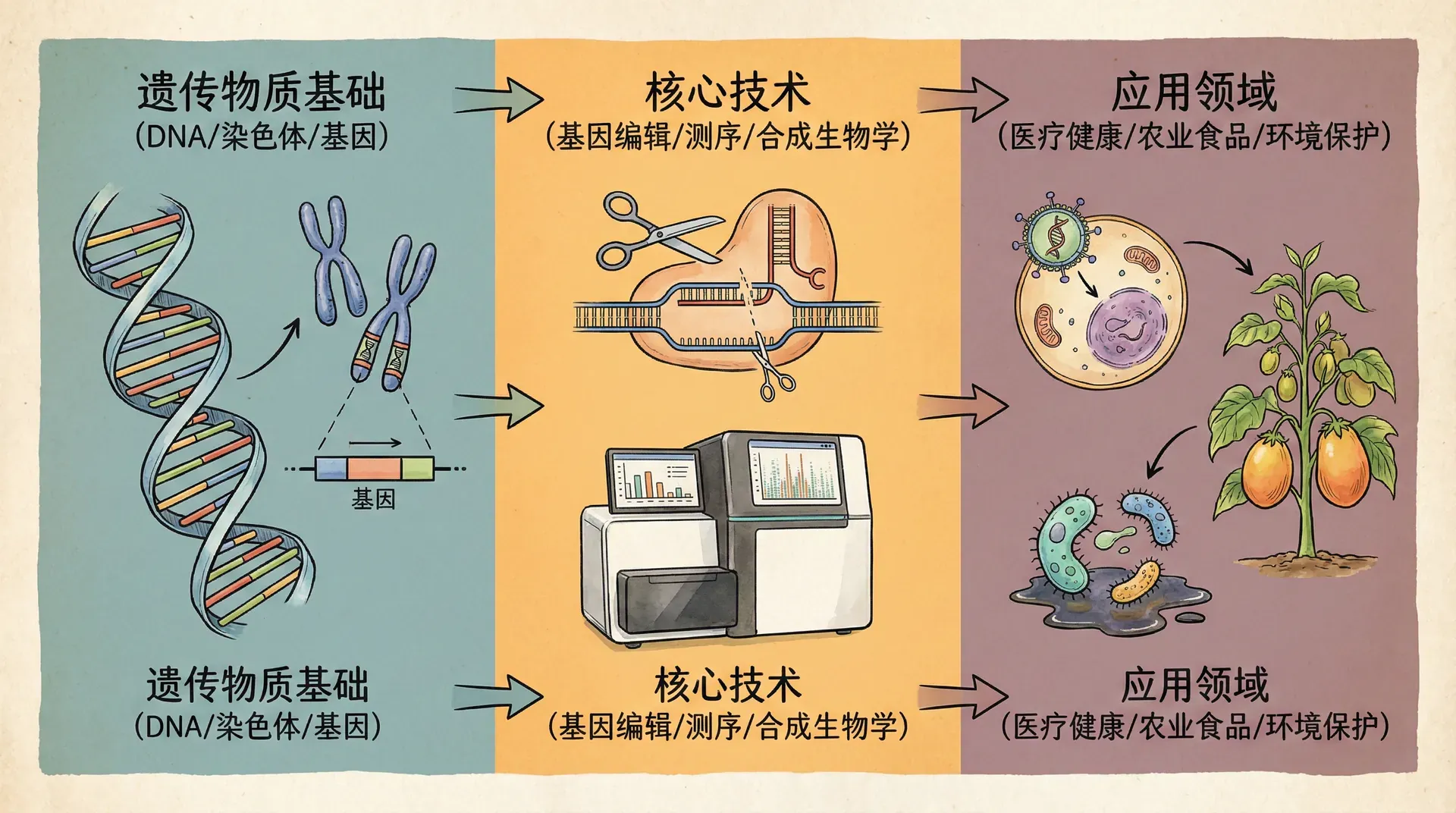
基因科学在21世纪迎来了史无前例的变革,其发展速度之快、影响范围之广令人瞩目。从2003年人类基因组计划的圆满完成,到近年来精准医疗和基因编辑技术的日益普及,现代基因科学正不断拓宽我们对生命本质的认知,并深刻影响着疾病的诊断、防治和人类健康的提升。在过去的二十年里,基因测序与分析技术的迅猛进步,使得原本耗资巨大、耗时多年的基因组测序工作,能够在数天甚至数小时内,以远低于过去的成本完成。随着技术的不断进步,基因科学正逐步从基础研究走向临床应用、农业改良和工业生物技术等多个领域,深刻改变着人类社会。
特别值得一提的是,中国在基因科学领域的成就尤为突出。无论是在大规模基因组测序、疾病相关基因解析、基因编辑等领域,还是将科研成果转化为临床诊断、个性化医疗和生物医药产业等创新应用方面,中国均处于国际领先地位。例如,中国主导或参与了多项国际合作项目,承担了大量人类和动植物基因组的测序与注释工作。在基础研究之外,中国的基因科学也快速实现成果落地,实现了科研与产业深度融合,助力健康中国战略的实施。
基因科学不仅是一门研究遗传信息的学科,更是现代医学、农业和生物技术产业发展的核心驱动力。它推动着精准医疗、基因编辑育种、生物制药等前沿产业的快速发展,为解决人类健康、粮食安全和生态环境等重大问题提供了新的技术路径。
人类基因组的奥秘
基因组结构与基本特征
人类基因组是一个包含约30亿个碱基对的庞大信息库,这些基因信息被有序地分布在23对染色体上。可以形象地说,基因组是每个人独一无二的“生命说明书”,储存着决定外貌、代谢、疾病易感性等多种生物学性状的全部遗传信息。尽管看起来复杂难解,但科学家们已经对其结构有了较为深入的认识。
从结构上来说,人类基因组并不仅仅包含编码蛋白质的基因,大部分DNA序列的功能还未被完全揭秘。我们可以用图书馆的比喻更为直观地理解:想象基因组是一座规模宏大的图书馆,染色体相当于分区的书架,基因是书架上存放的书籍,而DNA序列就像书中数以亿计的文字。其中,真正直接编码蛋白质、决定性状的“有用文字”仅占全部基因组的2—3%;而绝大部分遗传信息以非编码区(包括非编码RNA、内含子、重复序列等)形式存在,它们的具体作用是当前基因科学持续探索的前沿领域。近年来,科学家还陆续发现非编码区域的很多序列在调控基因表达、维持细胞功能等方面具有极其重要的作用。
中国人群基因组研究的重要发现
中国科学家在人类基因组的多样性研究和精准医学领域取得了一系列具有国际影响力的成果。鉴于全球人口的遗传多样性,建立适合中国人群的基因组数据库对于疾病预防、个性化医疗具有重要意义。2019年,中科院上海生科院等机构联合发布了首个中国人群参考基因组图谱,揭示了中国人在多个遗传位点上与其他人群的不同,丰富了全球人类遗传变异的知识体系。这些研究的推进,为中国人群开展疾病易感性分析、药物基因组学和遗传病筛查等提供了坚实的数据基础。
不仅如此,中国科研团队还深度参与了与慢病、肿瘤等重大疾病相关的基因组大数据研究。例如,“炎黄基因组计划”系统梳理了中国人群特有的遗传变异,发现了超过300万个中国人独有的变异位点,为民族精准医疗与药物开发奠定了科学基础。中国代谢性疾病基因组研究发现了许多与糖尿病高度关联的新易感基因,有效提升了本土疾病风险模型的科学性和准确性。中国人群癌症基因组图谱、肝癌、肺癌等多癌种全基因组变异谱的发布,为个体化、靶向治疗策略的制定提供了重要理论支撑。
中国人群基因组研究的一个重要发现是,约15%的药物代谢相关基因变异在中国人群中具有独特性,这为发展适合中国人的个性化用药方案提供了科学依据。同时,这些基因组大数据和分析技术的不断积累与进步,预示着中国在全球基因科学领域的话语权和技术影响力正不断提升。
基因检测与分析技术
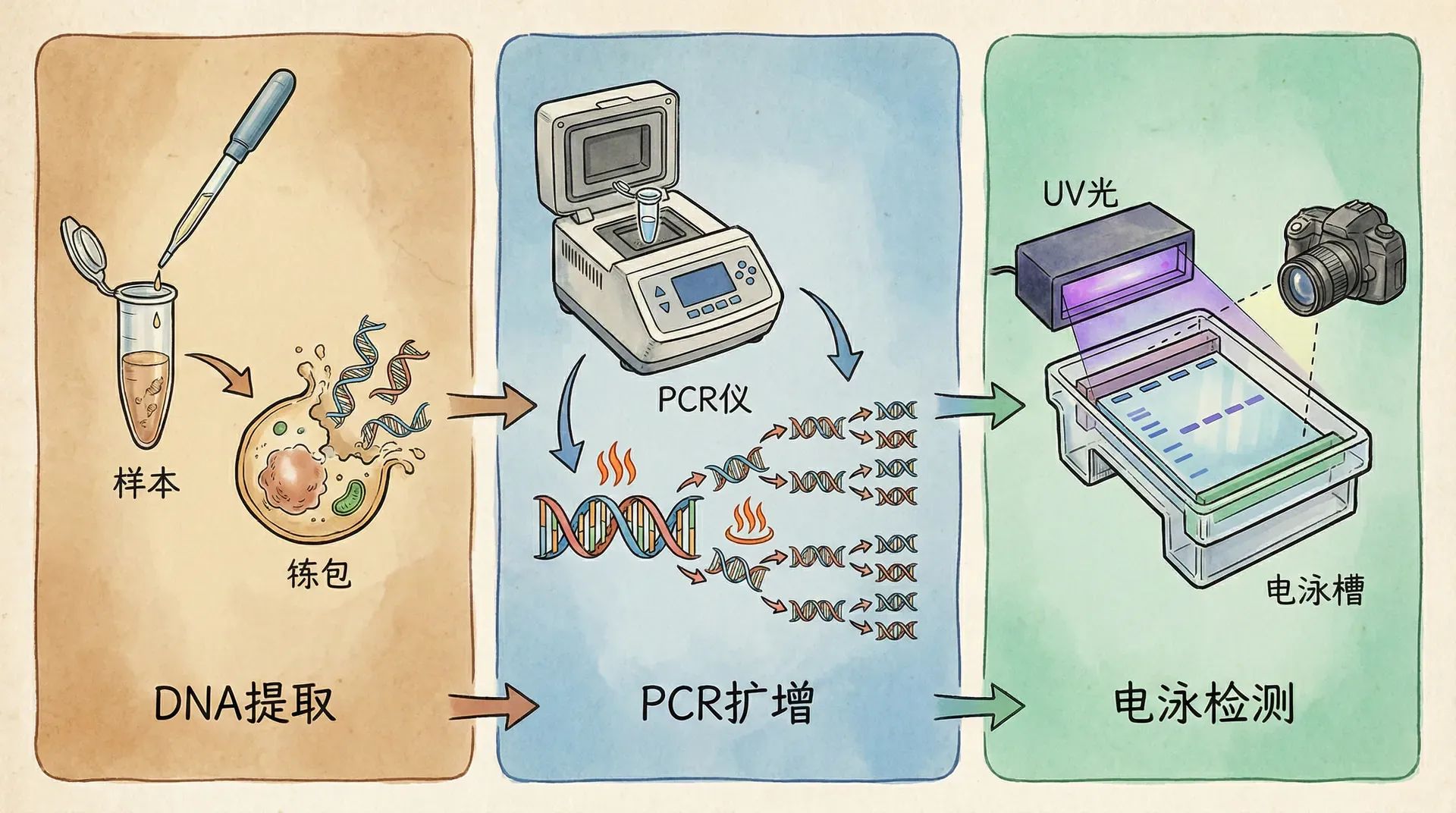
DNA检测的基本原理
DNA检测技术是现代生命科学的基石工具,其核心原理是基于DNA分子的碱基互补配对,通过设计专一的“探针”识别并结合目标基因序列——就像用一把专用钥匙在庞大的遗传信息库中找到唯一的一把锁。
最为典型的是PCR(聚合酶链式反应),能够在极短时间内将极低浓度的目标DNA片段扩增到可检测水平。该过程可细分为变性、复性和延伸三个基本步骤,每轮循环目标DNA数量即以指数方式递增,正如用高倍放大镜一点点聚焦到关键字句并用高亮笔标记,使微小信号变得清晰可见。
随着技术进步,除了常规PCR,还出现了多种先进扩增检测手段:
- 实时荧光定量PCR(qPCR):可实时监控产物变化,用于病原体检测、基因表达分析等;
- 数字PCR(dPCR):高灵敏、定量精确,适合极微量样本分析;
- LAMP(环介导等温扩增):无需复杂设备、快速出结果,常用于现场快速检测;
- 新一代测序(NGS):一次性解析上百万条DNA,适合全基因组分析或多基因位点并行检测,成为医学基因组、肿瘤和微生物领域的主流工具。
各类基因检测技术比较
基因检测技术的实际应用
基因检测技术如今早已深入中国医疗、农业、食品安全和司法等多个领域,正在构建健康社会与质量社会的基石。例如:
-
新生儿遗传病筛查
中国已建立全国性的遗传代谢病网络,通过新生儿足跟血检测,可以早期发现如苯丙酮尿症(PKU)、先天性甲减等病症,及早干预,大幅降低相关残疾率,为儿童带来更多健康与希望。 -
肿瘤精准医疗
以肺癌为例,医生通过检测EGFR、ALK、KRAS等基因突变类型,可精准匹配靶向药物,实现“个体化治疗”。不断扩展的多基因联检方案,为乳腺癌、结直肠癌、淋巴瘤等多类肿瘤患者提供指导。 -
非创伤性产前筛查(NIPT)
通过孕妇外周血捕获胎儿游离DNA,无创预测唐氏综合症及多种染色体疾病,大幅减轻孕妇心理和身体负担。 -
地中海贫血基因携带者筛查
在广东、广西等地,学校、育龄人群可通过基因检测,及早知晓携带状态,实现优生优育。 -
食品安全
基因检测可判别转基因成分、动物疫源污染,甚至追溯食品原材料来源,有效防止掺假或安全隐患。 -
司法鉴定(DNA指纹)
用于刑事侦查、亲子鉴定和身份确认,具有极高准确率。
尽管基因检测技术能力强大,其科学解读需依赖专业医生和遗传咨询师。基因检测反映的是风险概率,不等同于确诊结果,避免过度解读和恐慌,是合理应用现代医学成果的关键。
个性化医疗的发展前景
药物基因组学的突破
药物基因组学(Pharmacogenomics)关注个体基因组对药物反应的影响。每个人的基因组就像一份独一无二的说明书,决定药物在体内的吸收、分布、代谢与排泄过程。通过基因检测为不同患者“量身定制”用药方案,已逐步从实验室走向医院临床。
案例举例:
华法林个体化用药:
- 大约30%的中国人携带CYP2C9和VKORC1等与华法林代谢密切相关的基因变异。
- 药物基因检测可指引剂量调整,避免出血等严重不良反应。
- 《华法林个体化用药指南》已被北京协和、上交大医学院等200余家医院采纳,造福数十万患者。
癌症靶向用药:如吉非替尼用于EGFR突变型非小细胞肺癌,药物基因组检测直观提升疗效,减少无效治疗。
精神类药物优化:精神分裂症、抑郁症患者基因检测氯丙嗪、利培酮等药物代谢相关位点,可有效降低药物副作用,提高个体化治疗的安全性和依从性。
随着检测成本持续下降和医保政策的逐步覆盖,个体化用药模式有望逐步拓展为常规临床路径,推动精准医疗全面升级。
精准医疗在肿瘤治疗中的应用
精准医疗是肿瘤治疗领域一场深刻革命。以基因分型为核心,医生能为每位患者制定“量体裁衣”式的方案,大幅提升生存率和生存质量。
例如,患者通过检测EGFR突变、ALK重排、ROS1重排、BRAF突变等,可直接决定是否采用吉非替尼、奥希替尼、克唑替尼等靶向药物而非传统化疗。这一转变大幅提升五年生存率。如EGFR突变型肺癌患者,靶向治疗五年生存率从15%提升至65%以上。
精准医疗的综合路径包括:
- 大数据与多组学分析:融合基因组、转录组、蛋白组等信息,综合判断肿瘤“图谱”。
- 分子分型/分层诊治:对患者进行详细亚型分层,选择最优诊疗与药物组合。
- 动态检测与耐药机制监控:定期追踪肿瘤变异,及时调整药物方案以应对耐药发生。
例如,中南大学湘雅医院等精准医学中心采用基因组检测与多组学分析,为晚期肺癌患者量身定制治疗方案,实现中位生存期由8个月提升至24个月以上,相关研究成果获国际医学期刊高度评价。
随着人工智能、全组学大数据、临床知识库等融合,中国个性化医疗将在更多疾病领域为患者带来全新希望和生命质量提升。
基因治疗与再生医学
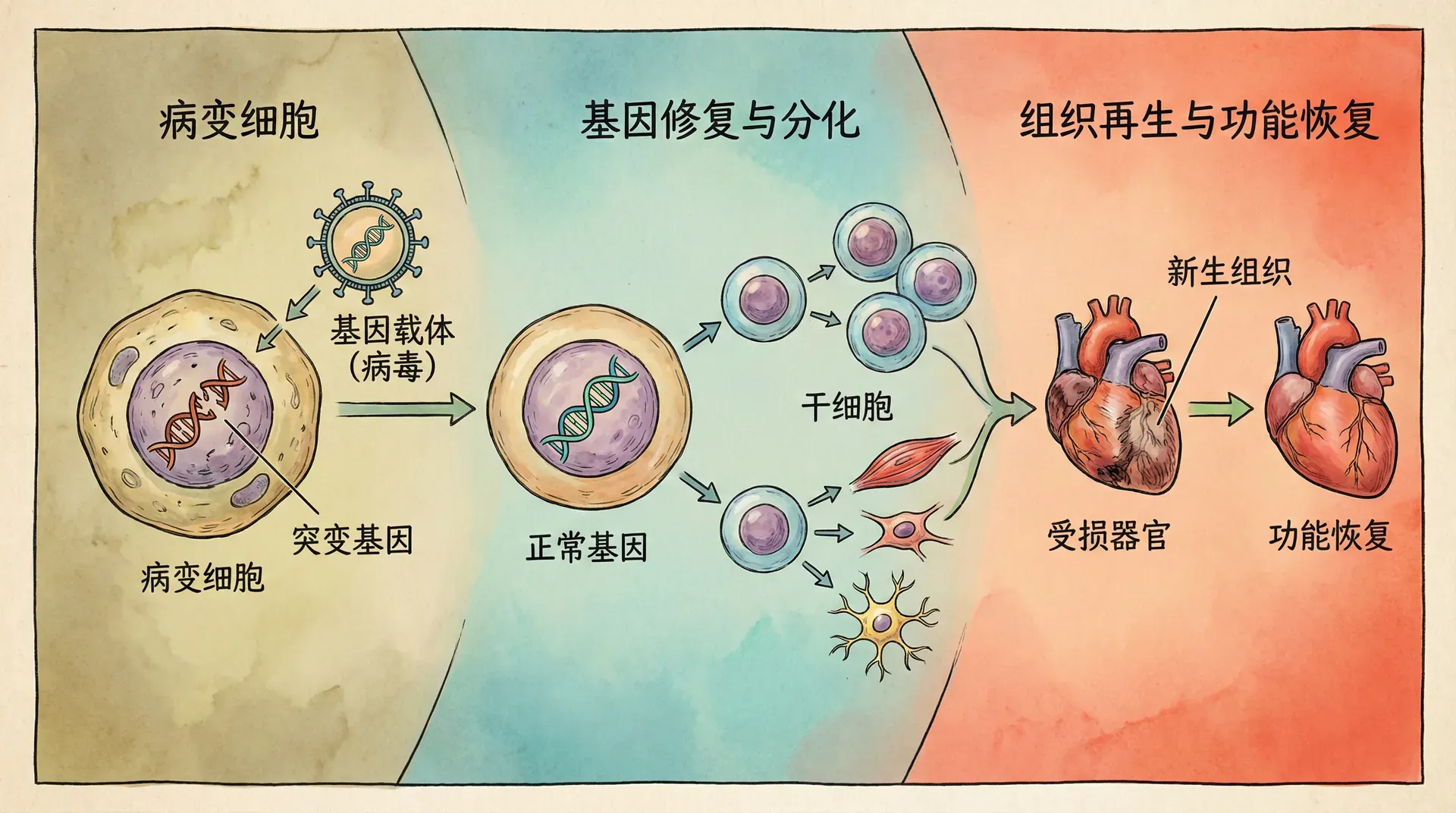
基因治疗技术的新进展与应用
基因治疗作为当代生命科学最具突破性的创新之一,其根本思想是从分子层面矫正或修复导致疾病的遗传异常。可以形象地说,基因治疗如同“为生命编写补丁”,从根源着手,实现对疾病的彻底干预和治愈。当前主流的基因治疗策略大致包括以下三种:
- 基因替代:向体内导入正常功能基因,修复或替换缺陷基因,常用病毒作为转运载体。
- 基因沉默:利用RNA干扰等方式抑制异常基因表达,切断病理过程。
- 基因编辑:借助CRISPR等工具,对DNA进行精准修改,实现定点纠错。
近年来,中国基因治疗领域屡获突破。例如,2023年复旦大学附属眼耳鼻喉科医院完成了全球首例Leber先天性黑朦症患者的基因治疗,助力失明者重见光明。与此同时,AAV(腺相关病毒)载体逐渐成为基因递送的主流;在地中海贫血、遗传性视网膜病和各种罕见病的治疗研究中,从基础理论到临床应用形成了贯通体系,还积极参与国际协作。
以下汇总主要基因治疗策略及代表性领域:
中国本土案例包括免疫细胞疗法(如CAR-T细胞用于血液肿瘤)、腺相关病毒介导的视网膜疾病治疗、β地中海贫血的基因编辑尝试等。部分新疗法已经进入临床实践或试验阶段,推动从科研到医疗转化。
与此同时,基因治疗涉及多项重要挑战,尤其是安全性和伦理问题。例如如何降低脱靶风险、规范胚胎或生殖细胞编辑、防止商业不当应用等已成为社会和法规监管的焦点。我国持续完善相关法律制度,并强化大众科普,推动基因治疗朝着安全、理性、健康的方向发展。
干细胞技术与组织工程的突破与融合
干细胞被誉为“生命修复工具箱”,它们具备自我更新和分化为各种细胞类型的能力,为组织修复与器官再造提供了理论与实践支持。例如,中科院动物研究所建立了人类胚胎干细胞系,为多种重大疾病的替代治疗(如糖尿病、脊髓损伤、帕金森病等)提供了细胞资源。
中国的干细胞及其临床应用持续加速,在间充质干细胞、造血干细胞、自体与异体移植等领域不断突破,多项临床试验带来患者直接受益。近年来干细胞技术重点方向及成果,可参考下表:
2020年,国内团队首创利用诱导多能干细胞(iPSC)培养角膜上皮细胞,并成功实施全球首例iPSC角膜移植手术。这不仅令患者重获视力,更标志着我国干细胞转化医学迈上新台阶。iPSC技术也被广泛应用于红细胞、心肌等功能细胞的再生,为攻克复杂疾病确立了坚实基础。
中国科学家正持续拓展iPSC的再生医学边界,不仅角膜领域成果显著,在神经系统、心血管系统、血液疾病等领域的研究同样快速推进,未来有望带来更多突破性治疗方案。
组织工程的核心在于融合生物材料、干细胞和生长因子等多学科手段,突破传统医学极限。例如,清华大学开发的3D生物打印技术,可打印带血管的心肌组织,大幅提升心脏病和器官修复的希望。全国众多科研团队也在探索体外“类器官”培养,用于疾病模拟、新药开发和个体化诊疗。
总结来看,干细胞与组织工程已成为再生医学全球竞逐的前沿阵地。随着分子机制研究深入、临床标准建立和伦理规范完善,未来这些技术有望为多种疑难疾病带来真正可治的希望,助力中国在国际再生医学舞台占据重要位置。
总结
基因科学的极速发展,为疾病防治、健康管理、生命认知和相关产业带来了前所未有的新机遇。从个性化医疗、靶向治疗到合成生物学和再生医学,现代生物技术正逐步从“科学前沿”渗透到每个人的日常生活,深刻改变着医学范式和健康观念。
中国不仅在基础研究领域跻身世界前列,更在临床转化、产业升级和国家战略层面全面布局,不断推动原创成果产业化。在基因编辑、细胞和基因治疗、干细胞临床应用、人工智能辅助诊断、医学大数据平台等方面均取得突出成就,引领医学模式向“精准—个体—智能”升级。
然而,随着基因技术走进社会大众,伦理与社会治理课题日益突出。亟需加强科学普及,完善法律、政策和伦理规范,预防技术滥用,维护社会公正和人的尊严。只有在法治和伦理的护航下,基因技术才能成为造福全人类的利器。随着科研资金投入持续增加、跨学科交融加深以及国际协作的拓展,基因科学有望引发新一轮重大突破。从出生预测疾病到老年健康管理,从疾病治疗到生命延伸,每个公民都将在科技进步中获得实实在在的福祉。
基因科学的未来不仅取决于技术本身的创新突破,更取决于如何实现公平惠及、伦理安全和全民健康。推动科技进步与社会责任同行,是建设“健康中国”和人类共同体的重要基石。