现代生物技术的新发展
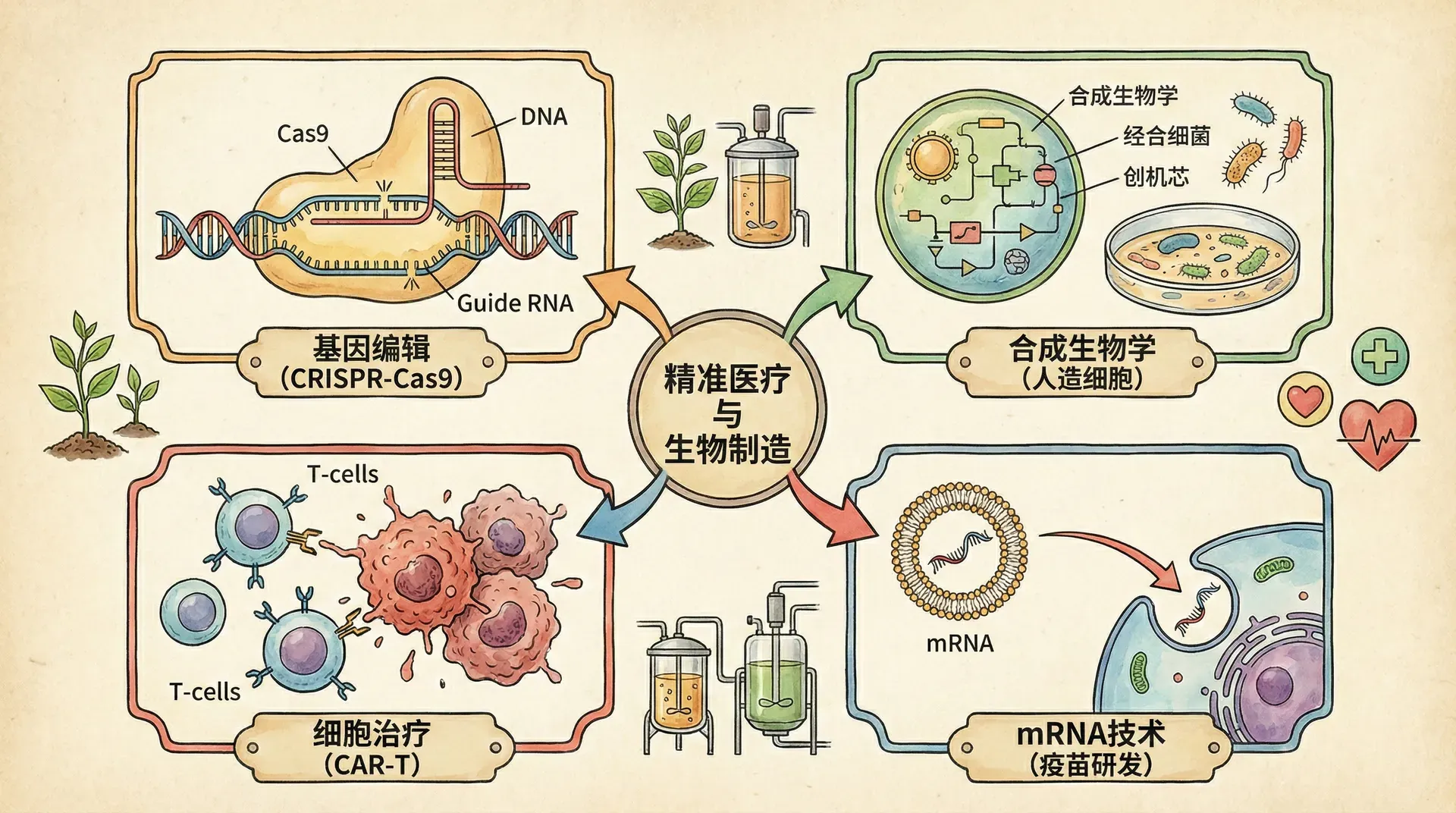
近年来,现代生物技术正以爆炸式的速度推动着医学和人类健康领域发生深刻变革。从21世纪初基因组测序、蛋白质工程到CRISPR基因编辑、干细胞定向分化、合成生物学等前沿领域的持续突破,生物技术呈现出多学科深度融合、技术门槛快速提升的趋势。这些创新技术不仅为疾病诊断和个体化治疗提供了强有力的工具,还在药物研发、疫苗设计、罕见病攻克及慢性疾病管理等方面拓展出前所未有的新路径。
例如,精准医疗使医生能够依据患者基因信息“量身定制”治疗方案,细胞与基因治疗则为诸如癌症、遗传病等医学难题带来了根本性解决的可能。随着人工智能与生物数据的深度融合,未来医学正逐步走向更加智能化、个性化和可持续发展,为人类健康带来前所未有的希望和广阔前景。
再生医学概述
再生医学是一门致力于修复、替换或再生人体组织和器官功能的前沿学科。与传统医学主要依赖药物和器官移植不同,再生医学强调激活机体自身修复机制,或以体外构建功能性组织来替换受损部位。这一领域的崛起源于传统治疗局限性的认识和对人体再生潜能的深入挖掘。
在自然界中,各类生物展现了多样的再生能力,例如:
再生医学以“细胞-支架-信号分子”为三大核心要素:
- 细胞:再生的基本单位,包括自体细胞、异体细胞、干细胞等;
- 支架材料:为细胞生长提供三维环境与结构支持,常见如胶原、PLGA、3D打印支架;
- 信号分子:调控细胞增殖、分化及组织形态发生,典型如各种生长因子。
三者协同构成组织工程的技术基础,不同再生方案侧重不同要素:
近年来,中国在再生医学领域取得了诸多突破。中国科学院及国内多所高校,推动了干细胞修复脊髓损伤、人工皮肤移植、软骨修复等临床转化。例如,2023年南京医科大学团队成功实现功能性肝脏类器官的动物体内再生,扩展了相关技术的边界。
重要历史节点时间轴(点击卡片查看详情)
发展脉络可见,现代再生医学正由基础研究不断向临床落地推进,尤其借助干细胞与3D打印等新兴技术。其突破离不开生物学、材料学、工程学和临床医学的多学科协作特性。
再生医学的多学科融合是其最鲜明的特点。例如,3D生物打印结合了工程制造、材料科学及组织细胞学的进步。当前,领域面临如精确调控细胞命运、血管化构建、免疫排斥与长期功能稳定等技术壁垒,但随着技术日益成熟,越来越多的成果开始服务真实病患。
再生医学应用图示(部分):
基因治疗技术
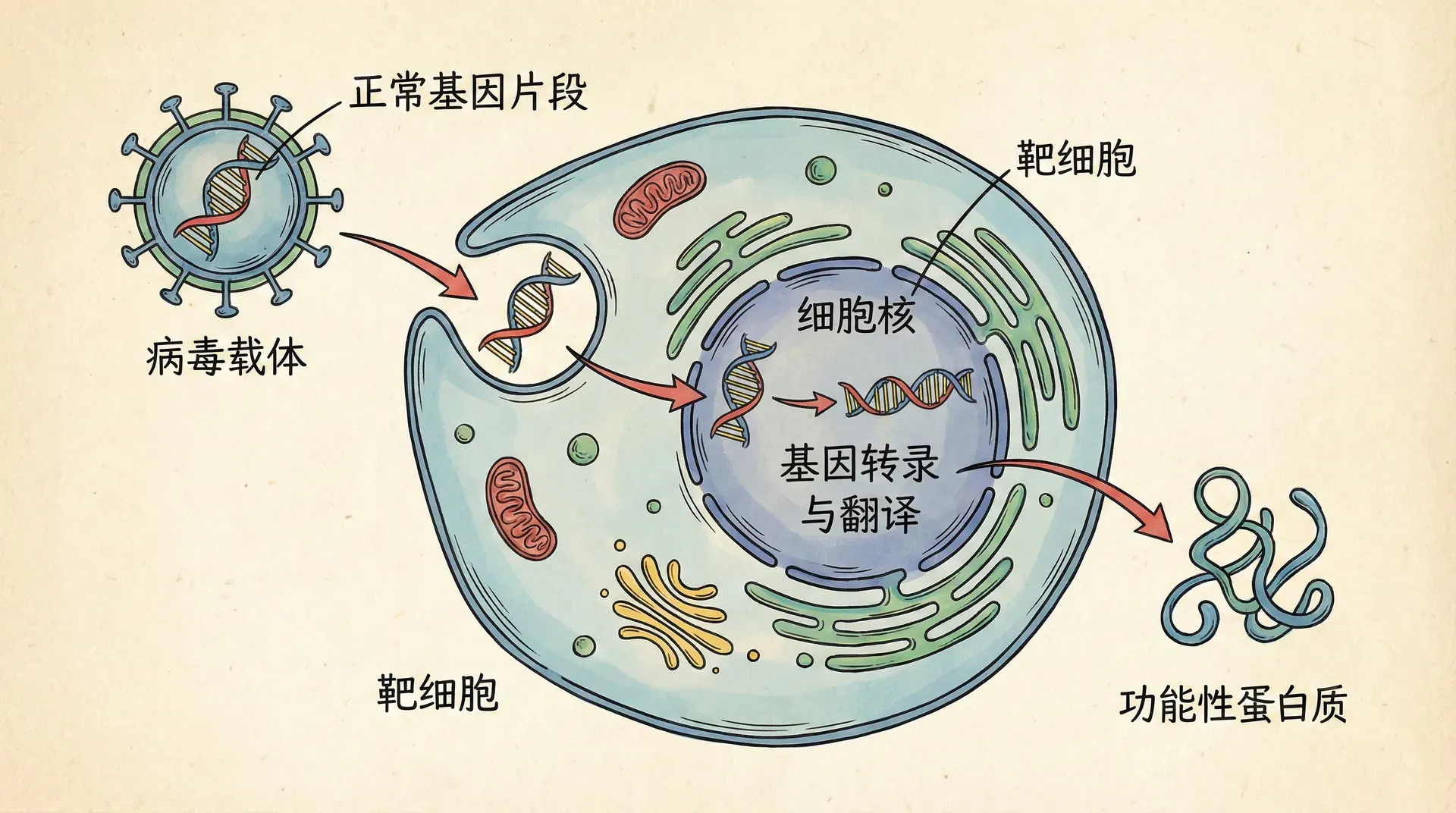
基因治疗是通过向患者体内引入正常基因或修正有缺陷基因,从分子根源上治疗疾病的方法。自20世纪70年代提出以来,已由设想到现实,并步入临床。
基因治疗策略大致分为基因添加与基因编辑两类:
- 基因添加:导入一个功能正常的“补充版”基因,补偿原有缺陷,无需切换原始序列;
- 基因编辑:直接用CRISPR-Cas9等分子工具修改DNA或RNA,修正异常基因,精准高但技术更复杂。
常用基因递送载体对比如下:
中国在基因治疗领域发展迅速。例如,2003年批准全球首款基因药物今又生(p53腺病毒注射液),2020年自主CAR-T产品上市。近期应用已涵盖肿瘤、遗传性眼病、血液疾病等。
如上图,全球基因治疗临床试验数在2012年后迅猛增长,这与CRISPR等精准基因编辑及AAV递送技术的产业化密切相关。中国近年来也极大加快创新脚步,在CAR-T和罕见病基因治疗等方面展现国际竞争力。
基因治疗应用领域举例:
2021年,中国首个自主研发的CAR-T细胞治疗产品瑞基奥仑赛注射液获国家药监局批准上市,标志着中国基因和细胞治疗领域实现关键性自主创新突破,进一步推进了国产基因疗法的临床与产业化进程。
尽管进步显著,基因治疗仍面临如脱靶安全性、递送效率、免疫反应和高昂成本等问题。例如,单次CAR-T疗法费用往往高达数十万-百万元,普及仍受限。未来,随技术成熟与生产规模扩大,这些挑战有望逐步缓解,基因治疗将更多造福于广大患者。
细胞免疫疗法
细胞免疫疗法通过激活、增强或重定向患者自身或供体的免疫细胞,来识别并杀灭肿瘤细胞,是近年来肿瘤治疗领域的一大突破。人体免疫系统本身兼具高度的“警察”功能,但肿瘤细胞却善于伪装和逃脱。细胞免疫疗法的核心在于“武装”免疫细胞,让它们克服肿瘤的免疫抑制屏障,重夺杀伤主动权。
在正常状态下,T细胞通过TCR(T细胞受体)识别呈递抗原的细胞,启动免疫消灭异常细胞。然而肿瘤细胞通过以下机制逃逸监视:
- 下调MHC分子
- 过度表达免疫检查点(如PD-L1)
- 分泌免疫抑制分子等
为此,现代细胞免疫疗法以重构和增强各类效应细胞功能为目标,研发出多种新型策略。主要疗法归纳如下:
以CAR-T为例,其流程简要如下:
如上图,CAR-T细胞回输后体内迅速扩增(第10-20天内为高峰),此扩增期与肿瘤清除效应密切相关,随后数量回落但依然能维持较久,有助于延缓复发。
除了CAR-T,TCR-T细胞可识别胞内肿瘤抗原,适合特殊实体肿瘤;TIL疗法主要用于富含淋巴细胞的肿瘤,如黑色素瘤;NK细胞疗法因不依赖抗原特异性,也被探索于多种血液瘤及部分实体瘤。
近年来中国在细胞免疫疗法领域成果突出:CAR-T临床试验数量全球第二,2021年首款国产CAR-T药物瑞基奥仑赛上市,仅数年间国产产品数量和可及性快速提升,价格也明显低于海外同类产品,惠及更多患者。
典型不良反应:
干细胞技术
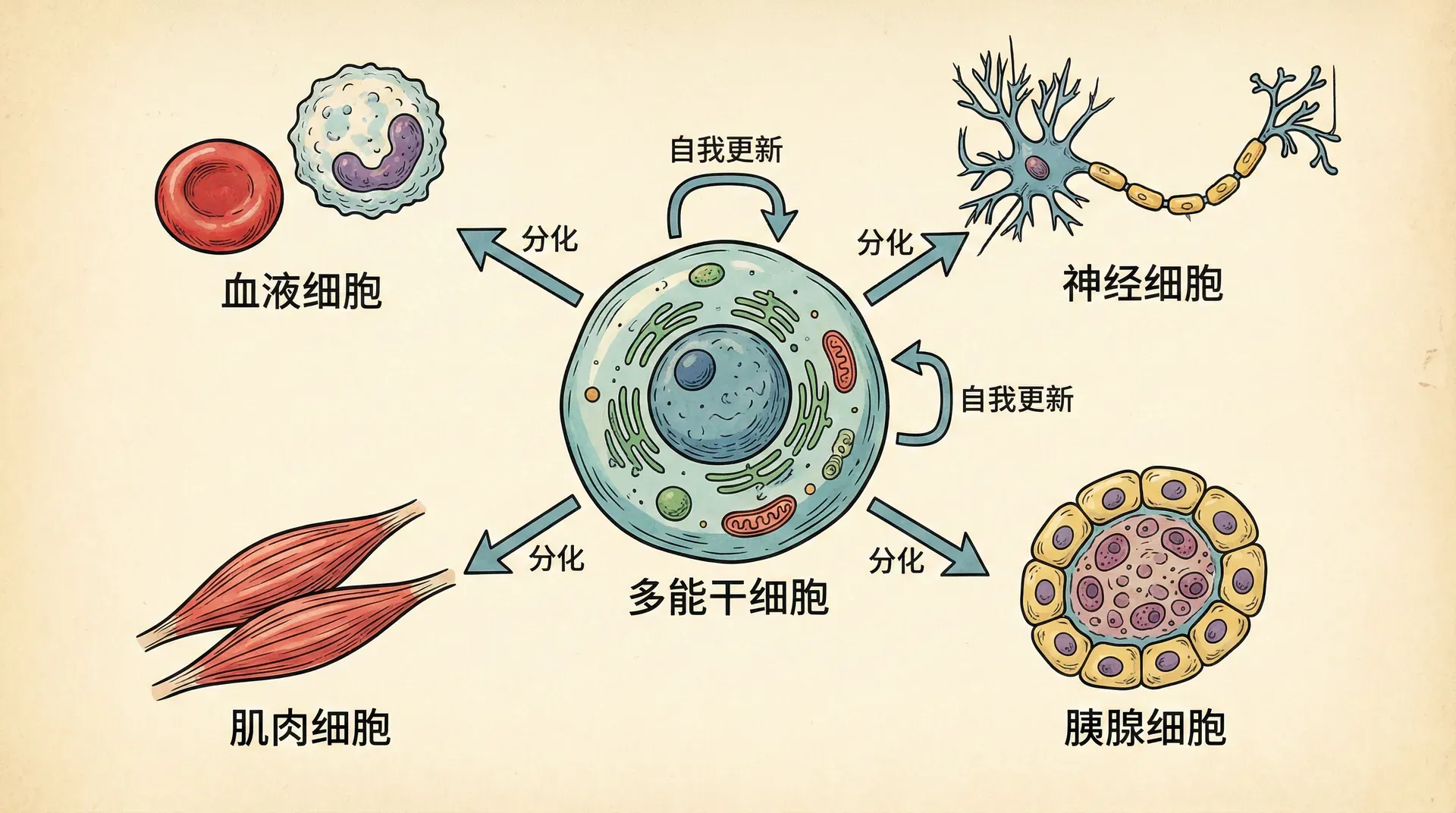
干细胞是具备分化潜能及自我更新能力的“万能细胞”,推动了组织修复、再生医学和疾病模型研究等多个领域。
干细胞类型与特点
- 胚胎干细胞(ESC):多能,易形成肿瘤,伦理争议较大
- 成体干细胞:分化有限,但来源广、安全性高。造血干细胞(骨髓移植)最早用于临床
- 诱导多能干细胞(iPSC):通过山中因子(Oct4、Sox2、Klf4、c-Myc)将成体细胞重编程为多能状态,避免伦理争议且支持自体移植,为科研和临床带来巨大拓展空间
应用与案例
- 疾病治疗: 干细胞取代受损组织细胞,应用于白血病(骨髓移植)、脊髓损伤、糖尿病、心衰、视网膜色素变性(如中国团队用ESC分化视网膜细胞返修损伤眼底)等领域。
- 疾病建模和药物筛选: 利用iPSC建立患者特异性的疾病模型(如长QT综合征心肌细胞),体外研究分子机制及快速评估新药效果。
- 再生医学突破: 干细胞结合3D生物打印等策略,已经实现在动物模型中重建耳廓、肌腱等复杂组织。
中国科学院干细胞团队在细胞重编程和分化方向调控等关键领域处于国际领先地位。目前,国内已建立起国家及区域性的干细胞库,为基础研究和临床创新应用提供了重要支撑。多项干细胞相关的临床试验正在推进,覆盖了脊髓损伤、糖尿病、肝硬化等多种疾病,展示了中国在该领域的积极探索和实际进展。
干细胞疗法虽富前景,但绝大多数项目仍处试验/研究阶段,切忌盲信机构宣传,务必选择正规医院和获批项目,以防延误病情和不良后果。
干细胞技术难题
随着基因编辑、单细胞组学和合成生物学的进步,干细胞领域的这些障碍正逐步被突破,未来有望实现更多疾病的治愈和组织再生。
组织工程
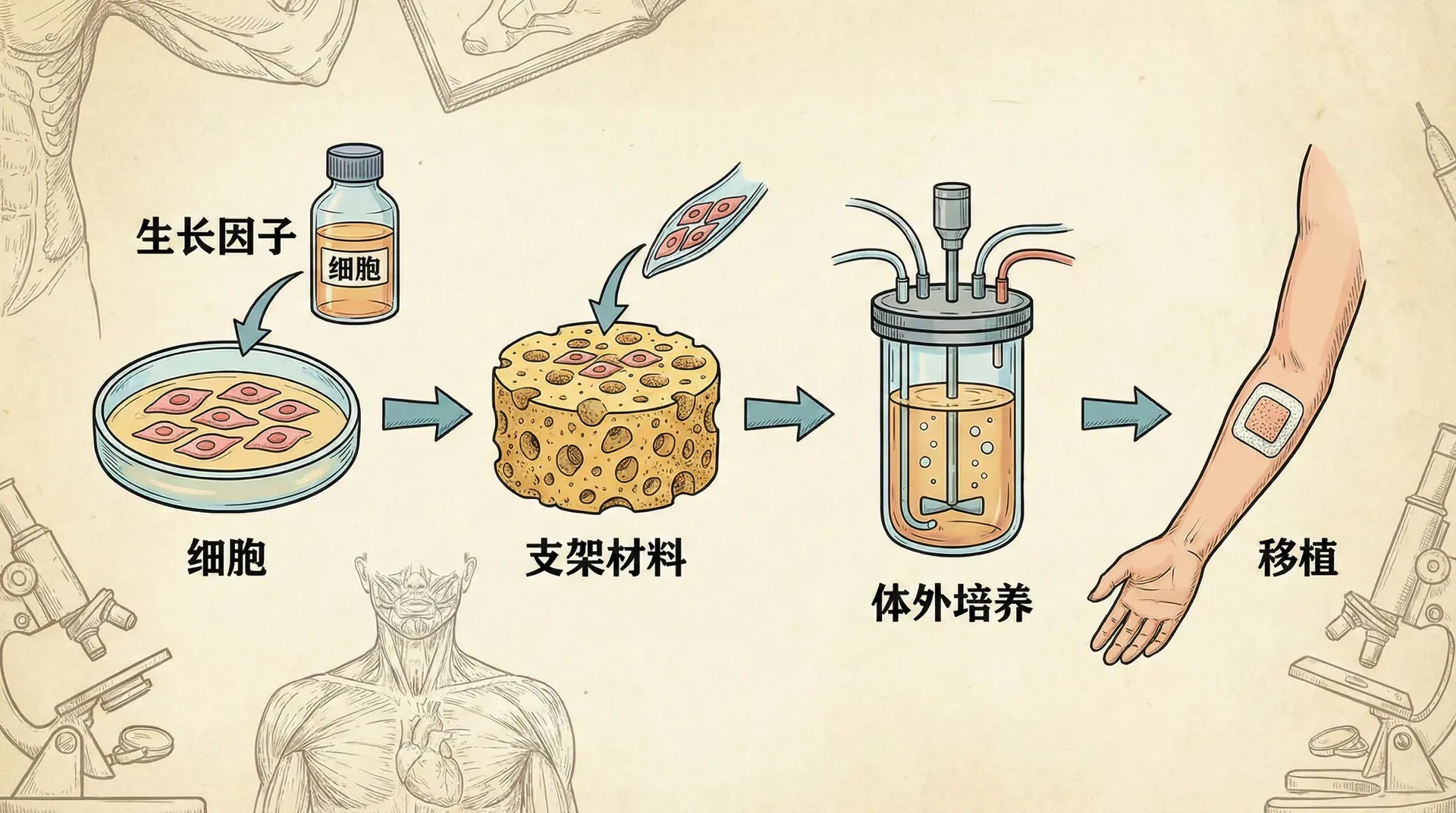
组织工程是再生医学的重要分支,通过结合细胞、生物材料与生物活性分子,构建功能性组织和器官,旨在解决器官移植供体短缺的问题。以中国为例,每年等待移植的患者数量远超可供器官数量,因此组织工程为定制化组织修复提供了希望。
实现组织工程需三大核心要素协同作用:种子细胞、支架材料、生长因子/信号分子。下方是对这三要素进行归纳:
支架的理想属性包括良好的生物相容性、适宜的机械强度、合理的降解速率,同时能够促进细胞的粘附、生长、分化与组织整合。在临床应用中,支架材料还需具备可控的孔隙结构,以便细胞和营养物质的渗透与输送,这对于组织再生的效果至关重要。
近年来,复合材料与智能功能化材料成为研究热点,科学家们通过在材料表面修饰特定生物活性分子(如细胞外基质蛋白、生长因子等),增强其生物活性,使支架能更好地模拟天然组织的微环境。此外,部分新型支架还具备响应性功能(如感应微环境变化释放信号分子),为实现多功能协同和精确调控提供了新的可能性。
如上图所示,理想组织工程中,初期支架为细胞提供结构支撑,随后逐渐降解,同时细胞生长形成新组织。当支架接近降解完成时,新生组织应具备充分的功能和机械强度。支架降解与再生组织的进度需合理匹配——降解过快会支撑不足,过慢可能形成炎症或妨碍组织重塑。
前沿技术与实际案例
三维生物打印推动了组织工程的变革。采用含细胞“生物墨水”,按照预设结构逐层“打印”组成复杂组织,优势在于空间精确可控,可实现微血管网络等复杂结构。近年已成功打印皮肤、软骨、小血管等,部分团队(如中国的同济大学、上海交通大学)已实现类似肝脏组织及胰岛模型的打印示范。
中国在生物材料、3D打印及组织再生等方面不断突破。例如人工皮肤广泛用于大面积烧伤患者修复,部分医院已将定制软骨广泛应用于关节疾病,3D生物打印血管及新型引导骨再生材料等逐步临床转化。
临床应用现状与挑战
不同组织类型在工程替代上的进展、挑战和典型应用差异较大,综合如下:
组织工程当前主要瓶颈包括:
- 大尺寸组织的血管化(厚度>200微米时需建立功能血管网,典型手段如支架预制血管通道、促血管因子、内皮细胞共培养);
- 复杂器官功能重建(如肝脏、肾脏需精细结构和多细胞协作);
- 长期力学稳定与生理整合;
- 智能响应材料及精准调控技术。
在2019年,以色列特拉维夫大学首次3D打印出含有血管、心室、心房结构的微型心脏,虽目前只能维持有限收缩功能,但充分验证了利用自体细胞打印复杂器官的可行性,为未来定制化器官移植提供极大想象空间。
未来发展方向
未来组织工程将呈现以下趋势:
整合生物学、材料科学、工程学、人工智能等多学科的新兴工具和理念,持续突破生物材料创新、细胞来源与调控、智能制造等关键技术瓶颈,将大幅推动组织工程从实验室基础研究逐步向规模化、可控化和个体化的临床应用迈进。随着这些前沿交叉领域的持续融合与技术迭代,组织工程将在疾病治疗、器官替代及个性化医疗等领域发挥更为广泛和深远的影响。
总结
再生医学为组织修复和器官替代开辟了全新的理论和技术路径。基因治疗可从根本上修复或替换异常基因,细胞免疫疗法通过改造免疫细胞提升抗病能力,干细胞作为“种子细胞”推动组织再生和修复,组织工程则通过细胞、生物材料与生物因子的结合,实现功能性组织器官的构建。这些前沿技术彼此协同与融合,如干细胞可应用于组织工程,基因编辑提升细胞功能,生物材料创新也不断拓展细胞治疗与工程应用的边界。
随着生物医学、材料与工程等多学科的深度交叉,创新成果正加速临床转化。面对器官移植供体短缺、复杂疾病修复等难题,这一系列技术正共同推动生物医学进步。可以预见,个性化、精准化和可再生的医疗将逐步成为现实,为更多患者带来福祉,也为人类健康事业提供更加广泛和深远的解决方案。