生物制药技术
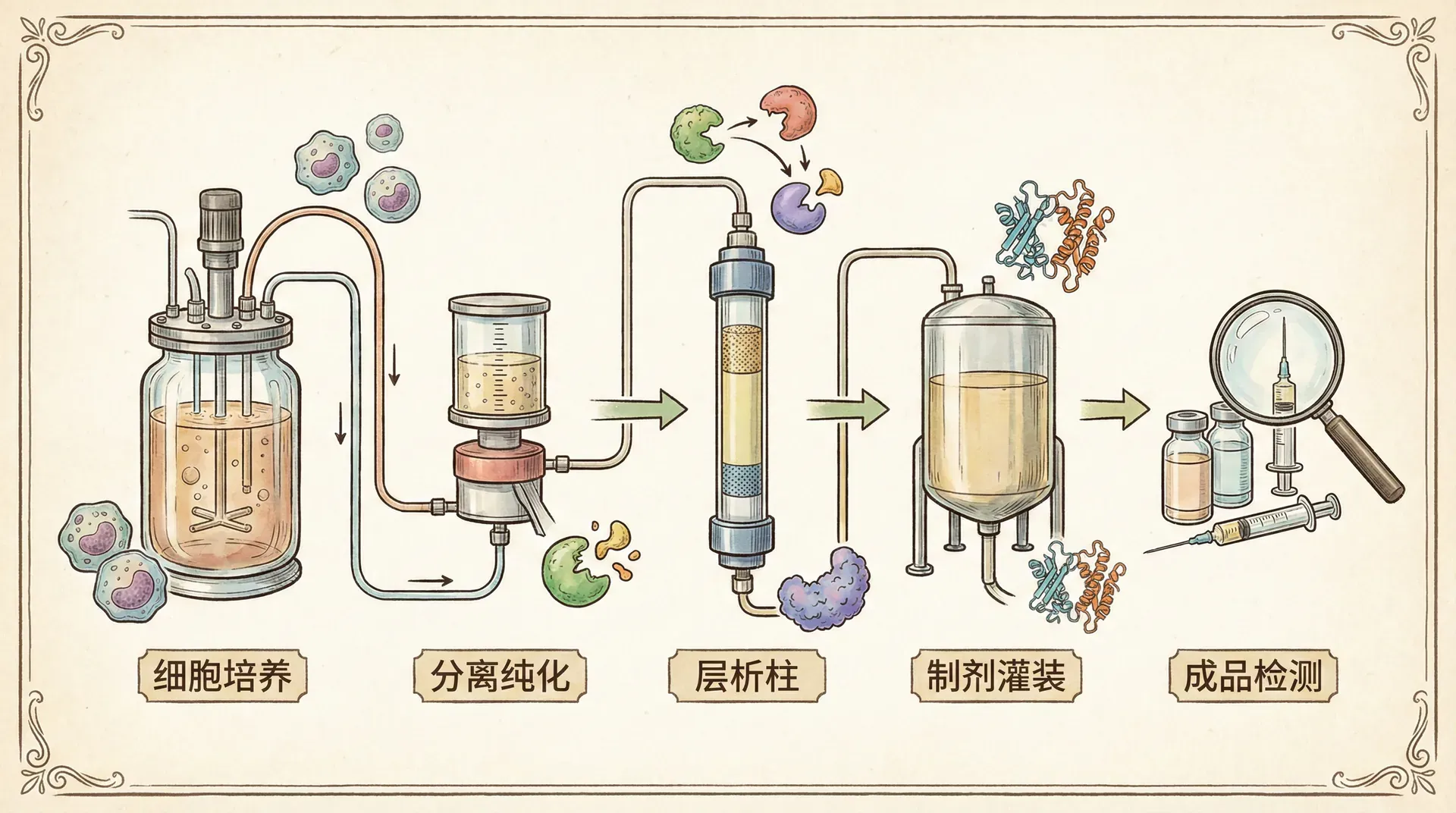
生物制药技术作为现代医药科技的前沿领域,融合了分子生物学、基因工程与工艺工程等多学科知识,利用微生物、动物细胞或植物等生物体系有效地合成和生产医疗用蛋白、疫苗以及细胞治疗产品。与传统小分子化学合成药物相比,生物药物往往具有更高的特异性、更少的不良反应,并可针对许多疑难疾病,如自身免疫病、肿瘤以及遗传性疾病,开发出创新疗法。
近年来,随着技术进步与政策支持,生物制药已成为中国医药产业的重要增长极。不仅重组蛋白药物(如胰岛素、促红细胞生成素)、抗体药物迅速推广应用,疫苗和基因治疗领域也实现了自主创新和规模化生产,越来越多国产生物药物走向国际市场,为全球患者带来更多治疗选择和健康福祉。
生物制药的生产系统
生物制药的生产依赖不同的生物系统作为“工厂”来表达和合成目标药物。这些系统主要包括微生物系统、动物细胞系统和植物细胞系统三大类。选择合适的系统不仅决定了药物的生产速度和成本,还直接影响到药物的结构和功能特性。因此,理解不同生产系统的优势与局限,是生物制药开发的基础。
下方总结了三类生产系统的主要特征:
微生物生产系统
微生物系统——特别是细菌(如大肠杆菌)和酵母——凭借其快速的生长和低廉的培养成本,被广泛用于简单蛋白质药物的工业化生产。例如,重组人胰岛素便是通过工程化大肠杆菌大规模合成的。其基本流程如下:
如上表所示,微生物发酵生产效率极高,适合快速批量生产。但由于细菌不具备复杂的蛋白翻译后修饰能力(如糖基化),其产品多用于结构简单的蛋白药物。对于活性高度依赖翻译后修饰的复杂蛋白,这一系统就力不从心了。
动物细胞生产系统
动物细胞系统,尤其以CHO细胞为代表,是目前复杂生物药(如单克隆抗体和某些凝血因子)的主流生产平台。CHO细胞能较好地模拟人体内的蛋白加工及修饰过程。不过,这一系统对生产条件要求高,包括:
- 培养基需含多种生长因子、维生素及氨基酸
- 培养环境需全程无菌
- 温度、pH、通气严密控制
例如,上海某生物公司的抗体工厂采用了20,000升生物反应器,通过工艺优化,单批蛋白表达量能够达到每升8克,年产量可达数百公斤,从而能够有效服务数万名患者。
下列简述了动物细胞系统对培养条件的要求:
其高成本和技术壁垒,是下游药品价格较高的重要原因,但也为复杂蛋白药的结构与活性提供了保证。
植物生产系统
植物生产为生物制药带来新思路。以烟草等作物为代表,通过基因转化技术,使植物短时间内快速表达药用蛋白。利用阳光和水即可驱动产业化,且生物安全隐患较低——常用作疫苗抗原或工业酶表达平台。
举例而言:
- 2009年H1N1流感大流行时,烟草植物可在6~8周内合成数百公斤疫苗抗原,而传统鸡胚法需半年。
- 我国一些团队也正探索利用水稻、玉米等粮食作物作为蛋白表达新平台,可明显降低成本与提高可及性。
植物系统优缺点对比如下:
上图展现了三类系统的成本结构对比。以动物细胞系统为基准,微生物系统的建厂和运营成本仅约为1/3,植物系统则不到1/6。这样巨大的差异直接影响药品定价,也决定了产业层面的选择策略。
单克隆抗体技术
单克隆抗体(Monoclonal Antibody, mAb)技术是现代生物医药领域的里程碑,被誉为“精准医疗时代的重要基石”。抗体是一类由免疫系统B淋巴细胞产生的Y形蛋白,能精准识别并结合病毒、细菌甚至肿瘤细胞表面的特定分子(抗原)。相比传统的多克隆抗体(由多种B细胞产生的混合物,特异性和纯度较低),单克隆抗体由单一B细胞克隆来源,结构一致、特异性极高,广泛应用于疾病治疗、诊断与科研。
单克隆抗体制备
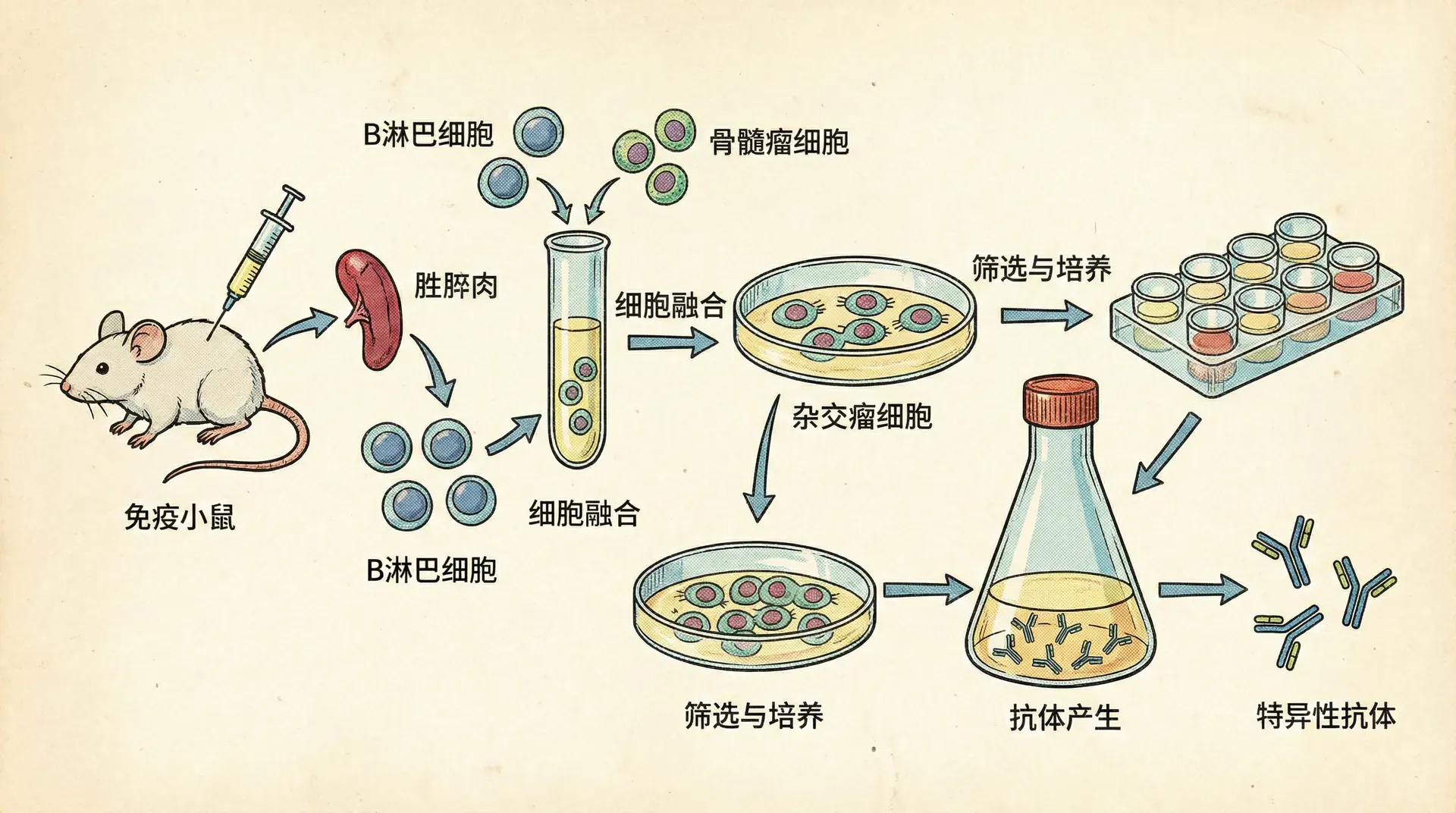
1975年,英国科学家César Milstein和Georges Köhler发明了杂交瘤技术,实现了单克隆抗体的体外大规模生产,并因此荣获1984年诺贝尔奖。其核心在于利用融合技术结合能产生目标抗体的B淋巴细胞和能无限增殖的骨髓瘤细胞,制备出既能分泌特定抗体又能“永生化”的杂交瘤细胞,从而源源不断获取高纯度抗体。
制备流程如下:
- 免疫动物:将目标抗原(如病毒蛋白或肿瘤相关分子)注射至小鼠体内,诱导免疫反应。
- 分离B细胞:数周后,从小鼠脾脏分离出大量B淋巴细胞。
- 细胞融合:在聚乙二醇等融合剂帮助下,将B细胞与骨髓瘤细胞融合,产生杂交瘤细胞。
- 筛选与培养:使用HAT培养基筛选杂交瘤细胞,并分布至微孔板,通过筛查确认其分泌目标抗体。
- 扩大生产:挑选阳性杂交瘤克隆,进行大规模培养,获取大量高纯度单克隆抗体。
下面对比多克隆与单克隆抗体的主要差异:
现代抗体药物制备通常还需经历“亲和力成熟”、“重组表达”等环节,制备过程可精确调控抗体结构和功能。例如,某研究团队利用单克隆抗体技术精准筛选针对新冠病毒刺突蛋白的中和抗体,显著提升了COVID-19的治疗选择。
人源化与全人源抗体的发展
早期绝大多数单克隆抗体来自小鼠(即“鼠源抗体”),这些抗体注射人体后易被免疫系统识别为异物,诱发过敏、清除加快等不良反应。为此,科学家们研发了“人源化抗体”与“全人源抗体”技术:
- 人源化抗体:通过分子生物学方法,将鼠源抗体序列中与抗原结合的关键区保留,其余部分替换为人源结构,从而兼具高亲和力和低免疫原性。
- 全人源抗体:利用噬菌体展示、转基因小鼠等技术,使获得的抗体序列完全来源于人类,实现最小免疫反应。
以下是主要抗体类型的对比:
中国单抗药物进展
近年来,中国单克隆抗体技术快速发展。2019年,自主研发的PD-1抑制剂药物(如信达的信迪利单抗、君实的特瑞普利单抗等)获批上市,广泛应用于肺癌、肝癌、黑色素瘤等多种恶性肿瘤。
以一位晚期非小细胞肺癌患者为例,在标准化疗无效后,转而接受PD-1抗体类药物治疗,肿瘤体积明显缩小,生存期由原本的数月大幅延长至两年以上。到2023年,国内已有十余种自主研发的PD-1/PD-L1抑制剂获批上市,药品价格降至进口同类单抗的三分之一,大幅提升了患者的用药可及性。此外,近年来HER2靶向、EGFR靶向以及RSV、新冠等多类型创新抗体药物也在加速研发与上市,充分展现了我国抗体创新研发能力的迅速提升。
上图反映了单克隆抗体生产全过程中,抗体浓度的显著上升趋势:
- 0~8周:主要筛选优质杂交瘤克隆,抗体产量有限;
- 8~16周:克隆被批量扩增,抗体浓度大幅提升;
- 16周后:投产大规模生物反应器,每毫升抗体产量可达数毫克甚至更高,满足临床和工业需求。
单克隆抗体不仅在肿瘤、风湿、自身免疫等疾病治疗中展现出革命性作用,还推动了生物医药的国产化和可及性提升。目前,越来越多国产创新抗体药物正走向临床,实现“救命药物中国造”。
疫苗开发技术
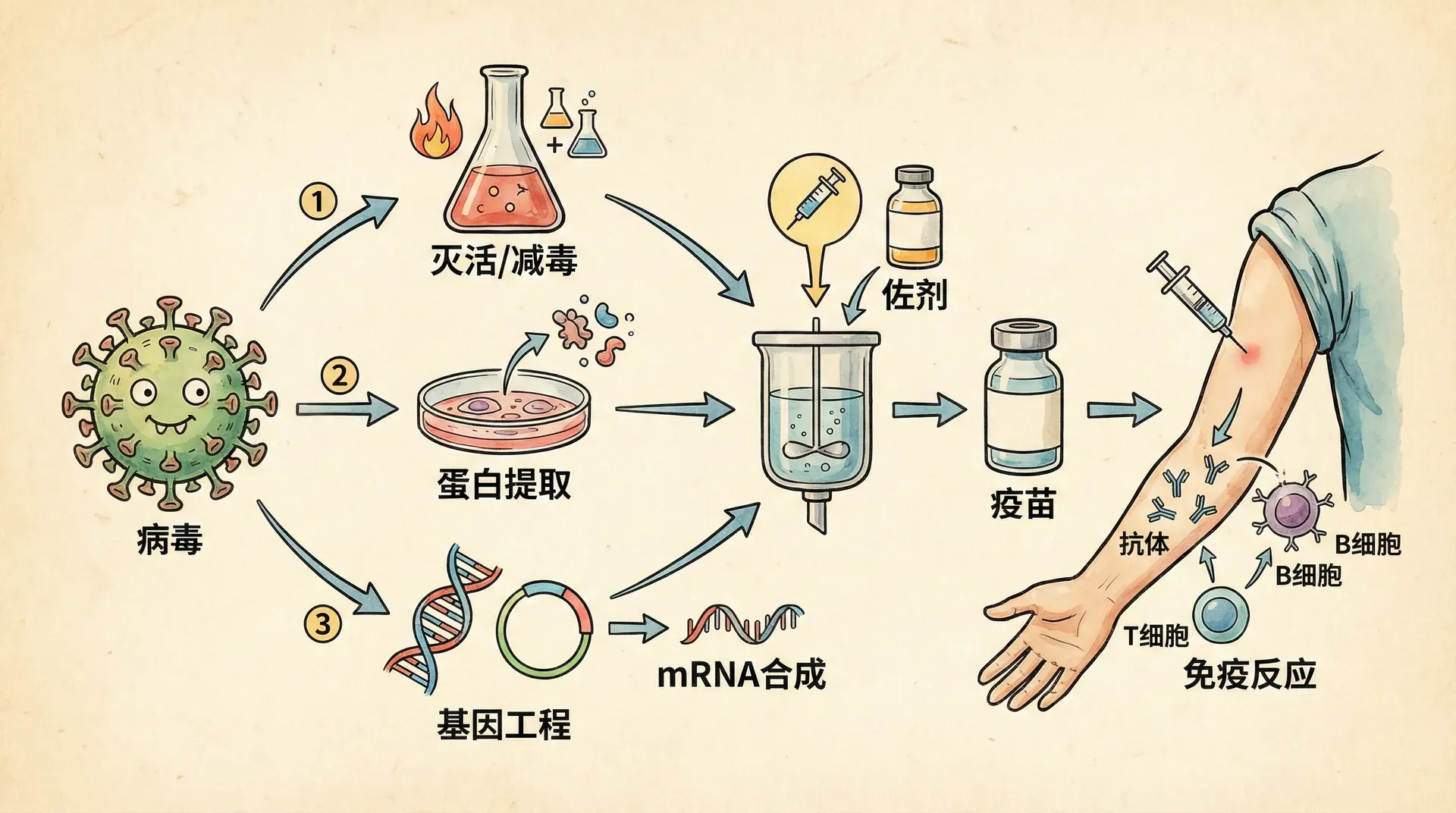
疫苗一直被认可为预防和控制传染病最有效且成本最低的手段。根据世界卫生组织的数据,疫苗每年能挽救200-300万人的生命。随着生物技术的迅猛发展,疫苗开发不再局限于传统的灭活疫苗和减毒活疫苗,越来越多现代疫苗技术方案被应用,比如亚单位疫苗、重组蛋白疫苗、核酸疫苗等,大幅提升了疫苗的研发速度与安全性。
不同类型疫苗及主要特点
重组蛋白疫苗
重组蛋白疫苗是指利用基因工程技术,将病原体的关键抗原蛋白质通过“异源表达”方式(如在酵母、昆虫细胞或动物细胞中)大量制备,并经过纯化后作为疫苗成分。这一方法不会引入完整的病原体,也不包含致病的遗传物质,因此具备极高的安全性和较低的副作用风险。
乙肝疫苗
- 原理: 通过工程化的酵母细胞表达乙肝病毒的表面抗原(HBsAg),再进行提纯制成疫苗。
- 成就: 乙肝疫苗广泛接种后,5岁以下儿童乙肝病毒感染率已从1990年代初的接近10%下降到目前低于1%。中国新生儿乙肝疫苗接种率已达到99%以上,极大降低了疾病负担。
宫颈癌疫苗(HPV疫苗)
- 新进展: HPV 疫苗利用主要衣壳蛋白L1自组装形成病毒样颗粒(VLP),既能有效诱发免疫反应,又几乎无感染风险。二价、四价和九价HPV疫苗分别覆盖了多个高危病毒型别。
- 中国进展: 国产二价HPV疫苗于2020年上市,极大降低了宫颈癌防控的疫苗门槛。同时实现高性价比,适宜广泛推广。
其他典型重组蛋白疫苗举例
核酸疫苗
核酸疫苗指的是直接将编码病原抗原的DNA或mRNA递送到人体细胞,使细胞自主合成抗原并激发免疫反应。该类疫苗是近10年来生物医药领域重大技术突破。发展初期以DNA疫苗为主,近年mRNA疫苗崛起并首次在新冠疫情中实现了全球大规模应用。
原理概述:
- mRNA疫苗通常通过脂质纳米颗粒递送,将合成的mRNA引入人体细胞,让细胞“仿生”表达病原的主要抗原片段。
- 产生的抗原被免疫系统识别,诱导体液免疫(抗体)和细胞免疫(T细胞)双重防线。
新冠疫情极大推动了核酸疫苗技术的发展。自2020年1月新冠病毒被发现,到mRNA新冠疫苗获得紧急使用授权,实际仅用时不到一年,远远突破了传统疫苗研发的周期极限。美国辉瑞/BioNTech,以及中国的康希诺、沃森生物等企业,都在核酸疫苗研发与产业化方面取得了重要突破。
核酸疫苗优势
核酸疫苗具备多项显著优势:
-
当遇到新发传染病时,只要获得病原体的基因序列,科研人员即可迅速设计出疫苗原型,大幅缩短了研发启动时间。
-
核酸疫苗的生产工艺流程高度标准化,可以实现规模化、自动化的快速量产,极大提升了疫苗供应能力。
-
从理论上讲,核酸疫苗具有较强免疫原性,不仅可以多次接种以增强免疫反应,还可灵活拼接多种疾病相关的肽段,实现多靶点防护。
中国疫苗研发与应用格局
中国在疫苗研发和推广中,实施了灭活疫苗、亚单位疫苗、腺病毒载体疫苗和mRNA疫苗等“多路径并行”的战略。例如,在新冠疫情防控中,灭活疫苗保障了疫情初期大规模接种,mRNA和重组蛋白疫苗则补上了技术升级和多样性供给,极大提升了覆盖人群和免疫保护水平。截至2021年底, 中国累计接种新冠疫苗剂次超过26亿,成为全球疫苗生产和应用的重要力量。
现代疫苗研发周期已大幅缩短。例如新冠mRNA疫苗,从病毒基因序列公布到大规模接种授权,仅用时不到一年;而传统疫苗通常研发周期为10-15年。疫苗开发进入了“平台化、智能化、速应化”的新时代。
上图对比了传统疫苗与mRNA疫苗的研发历程。传统疫苗开发总进度约90个月(约7.5年),mRNA疫苗仅21.5个月,周期缩短70%以上。这种跨越式提升,得益于核酸疫苗平台的成熟、高通量方法的推广,以及全球科学协作模式的建立。
基因工程在食品生产中的应用
基因工程技术不仅深刻变革了医药产业,在农业和食品生产领域同样带来了革命性的影响。通过对作物、动物或微生物基因的精准改造,我们能够实现农作物高产、优质、抗逆,加强食品成分的规模化生产,乃至开发具有特殊营养或健康功能的新型食品,极大丰富了人类食品的数量与种类。
转基因作物的创新历程
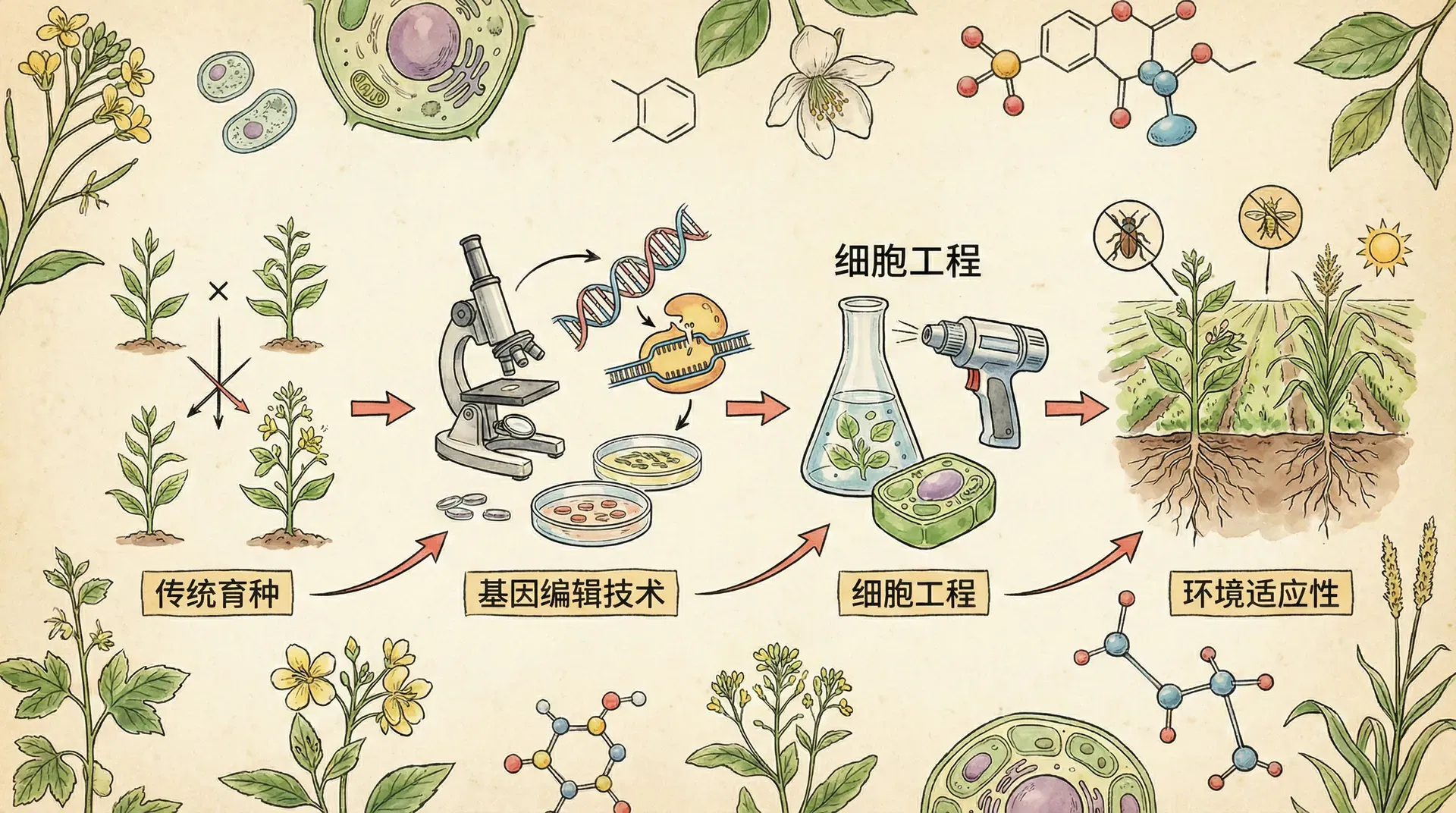
转基因作物即通过基因工程技术,将特定外源基因稳定导入农作物基因组,使其获得新的性状。自1996年美国首次商业化推广抗除草剂大豆以来,抗虫玉米、抗虫棉花、耐旱小麦等多类转基因作物已广泛应用于全球农业生产。
抗虫棉花的推广
20世纪90年代,中国棉铃虫灾害严重,农药大量使用既增加成本又污染环境。1997年,中国批准了Bt基因抗虫棉的商业化,极大减少了农药喷洒频次。到2010年,转基因棉花面积占全国的70%以上,带来显著经济和生态效益。而在美洲,转基因抗除草剂大豆和抗虫玉米已成为主流,大幅提升了粮食安全与生产效率。
微生物发酵与食品成分的工业化生产
基因工程微生物的定向改造推动了食品工业的现代化。相比传统工艺,经过分子育种优化的菌株不仅大幅提升了产率,还能减少环境负担。
例如:
- 柠檬酸的生产
传统方法依赖黑曲霉(Aspergillus niger)的自然发酵,现代工艺则通过加强柠檬酸合成酶基因表达、抑制副产代谢,显著提升出产率。中国现为全球柠檬酸头号生产与出口国。 - 氨基酸产业
谷氨酸钠(味精)、赖氨酸等重要氨基酸的工业生产,主要依赖对谷氨酸棒状杆菌或大肠杆菌的代谢通路工程化。例如,改造菌株可阻断谷氨酸进一步代谢,让谷氨酸在细胞中高浓度积累,生产效率是传统培养的数十倍,极大降低了成本。 - 功能性益生菌
科学家利用基因工程手段开发了能合成特定维生素、短链脂肪酸的益生菌,有望帮助改善人群肠道健康与营养摄入。
微生物发酵食品成分举例
基因工程驱动的功能性食品开发
随着人们对营养健康认知提升,功能性食品成为研究热点。基因工程为开发富含特定营养成分、特殊健康作用的新食品提供了有效工具。
- 黄金大米
典型代表,是通过整合来自水稻和玉米的关键基因,让水稻籽粒合成β-胡萝卜素(维生素A前体)。在维生素A缺乏高发地区,“黄金大米”有望有效预防儿童失明。 - 高铁高锌水稻、小麦
通过调控金属离子转运和积累相关基因,培育粮食作物,使其铁、锌含量显著提升,有利于改善缺铁、缺锌等微量营养素不足问题。 - 低致敏食品
利用基因敲除技术,降低花生、牛奶、小麦等常见过敏原的含量,帮助过敏体质人群扩展健康饮食选择。例如,低麸质小麦为乳糜泻患者带来福音。
近年来也有研究将抗氧化多酚类、n-3脂肪酸等保健成分通过代谢工程引入谷物或水果中,为慢性病防控提供新的膳食来源。
基因工程在食品行业的应用须严格通过多级安全与环境评估。中国实行严格的审批制度,所有转基因食品须通过环境安全和食用安全双重验证,并公开透明公示,只有证明与传统食品同等安全后方可上市流通。
应用举例及进展概览
以科技创新为驱动力,未来基因工程将在保障全球粮食安全、提升食品品质和营养结构、推动环境可持续发展等诸多领域持续发挥关键作用。中国科学家和产业界在相关研发与应用方面不断积累经验,不仅为本土民众带来健康福祉,也为全球面临的食品与生态难题提供了独具中国智慧的解决路径和创新方案。
随着基因编辑、合成生物学等前沿技术的深入应用,未来中国将在生物育种、新型食品、绿色农业等方向输出更多实践成果和解决方案,在国际舞台上发挥更大影响力。
总结
生物制药技术融合了生命科学与工程学,实现了从微生物发酵、动物细胞培养,到单克隆抗体与mRNA疫苗等多个领域的重大突破,极大推动了医药产业与人类健康事业的发展。在中国,随着技术进步,从依赖进口到自主创新,生物制药已进入快速发展阶段,涌现出PD-1抗体、重组蛋白疫苗、CAR-T细胞治疗等创新成果,标志着中国具备了完整的研发和生产能力。
然而,行业仍面临降低生产成本、提高疗效与安全性、完善质量控制、平衡创新与伦理等多重挑战。未来趋势将侧重个性化和精准医疗,多组学整合及人工智能、大数据等新技术将助力创新药研发提速。
对于生物技术学习者,理解这些原理及实际案例有助于夯实专业基础和创新思维。生物制药的进步离不开基础研究和跨学科协作,需要包括生物学家、化学家、工程师和临床医生在内的团队共同努力。保持科学好奇心与创新精神,是在这个充满机遇与挑战的领域不断前进的关键动力。