表观遗传学检测技术入门指南
什么是表观遗传学
我们的DNA就像一本厚厚的百科全书,里面记录着生命的所有信息。但是这本书太厚了,如果摊开放在桌子上,长度会达到3米!为了把这么长的“书”装进细胞核这个小小的空间里,细胞采用了一种巧妙的方法——就像我们用橡皮筋把报纸捆成一卷一样,DNA会绕在称为组蛋白的蛋白质上,形成一个个小包装,这些小包装叫做核小体。
DNA包装不是随机的,而是高度有序的动态过程,这种包装方式直接影响基因的表达活性。
这种包装方式并不是固定不变的。就像我们可以选择把某些重要的书页做标记,让它们更容易翻到一样,细胞也会在DNA和组蛋白上添加各种“化学标签”。这些标签告诉细胞哪些基因应该被激活,哪些应该保持沉默。这就是表观遗传学研究的核心内容。
在中国的农业研究中,科学家们发现当水稻遭遇干旱胁迫时,某些基因上的甲基化标签会发生改变,帮助水稻更好地适应恶劣环境。这个发现为培育抗旱水稻品种提供了新的思路。
表观遗传修饰主要包括以下几种类型:
DNA甲基化检测的基本原理
DNA甲基化就像是在DNA分子上贴“便利贴”一样。这些“便利贴”是甲基基团(-CH₃),它们主要贴在胞嘧啶碱基上,形成5-甲基胞嘧啶。这个过程就像我们在重要的书页上贴标签,提醒自己这一页的重要程度。
DNA甲基化是最稳定的表观遗传修饰之一,可以在细胞分裂过程中保持并传递给子细胞,这使得它在胚胎发育和细胞记忆中发挥重要作用。
在人体中,大约有70-80%的CpG位点(胞嘧啶和鸟嘌呤相邻的序列)都被甲基化了。这些甲基化的位点通常与基因的沉默有关。比如说,当肿瘤抑制基因的启动子区域被过度甲基化时,这个基因就会被“关闭”,无法发挥正常的抑制肿瘤的作用。
北京协和医学院的研究团队发现,在中国人群的肝癌患者中,某些特定基因的甲基化模式与西方人群存在显著差异,这为制定个性化的治疗方案提供了重要依据。
甲基化检测方法的分类原则
根据检测范围,我们可以把甲基化检测方法分为两大类:
位点特异性方法:就像用放大镜仔细观察某个特定的标签,这类方法专注于检测特定基因或区域的甲基化状态。适合已知目标基因的研究。
全基因组方法:就像用无人机俯瞰整片森林,这类方法可以同时检测整个基因组的甲基化模式。适合发现新的甲基化标志物。
位点特异性检测方法
甲基化敏感限制酶技术
这是最早发展起来的检测方法,原理非常简单直观。假如限制性内切酶就像一把特殊的剪刀,它只能在特定的DNA序列上“下剪”。而甲基化敏感限制酶更加“挑剔”,当它发现DNA上贴着甲基化标签时,就会“拒绝工作”,不再剪切DNA。
MSRE方法的最大优势在于操作简单、成本低廉,是初学者入门表观遗传学检测的理想选择。一个普通的分子生物学实验室就能完成这类实验。
中国科学院遗传与发育生物学研究所的科学家们利用这种方法,成功鉴定出了玉米中与抗病性相关的甲基化位点,为培育抗病玉米品种提供了重要线索。
实验操作流程
亚硫酸氢盐转化方法
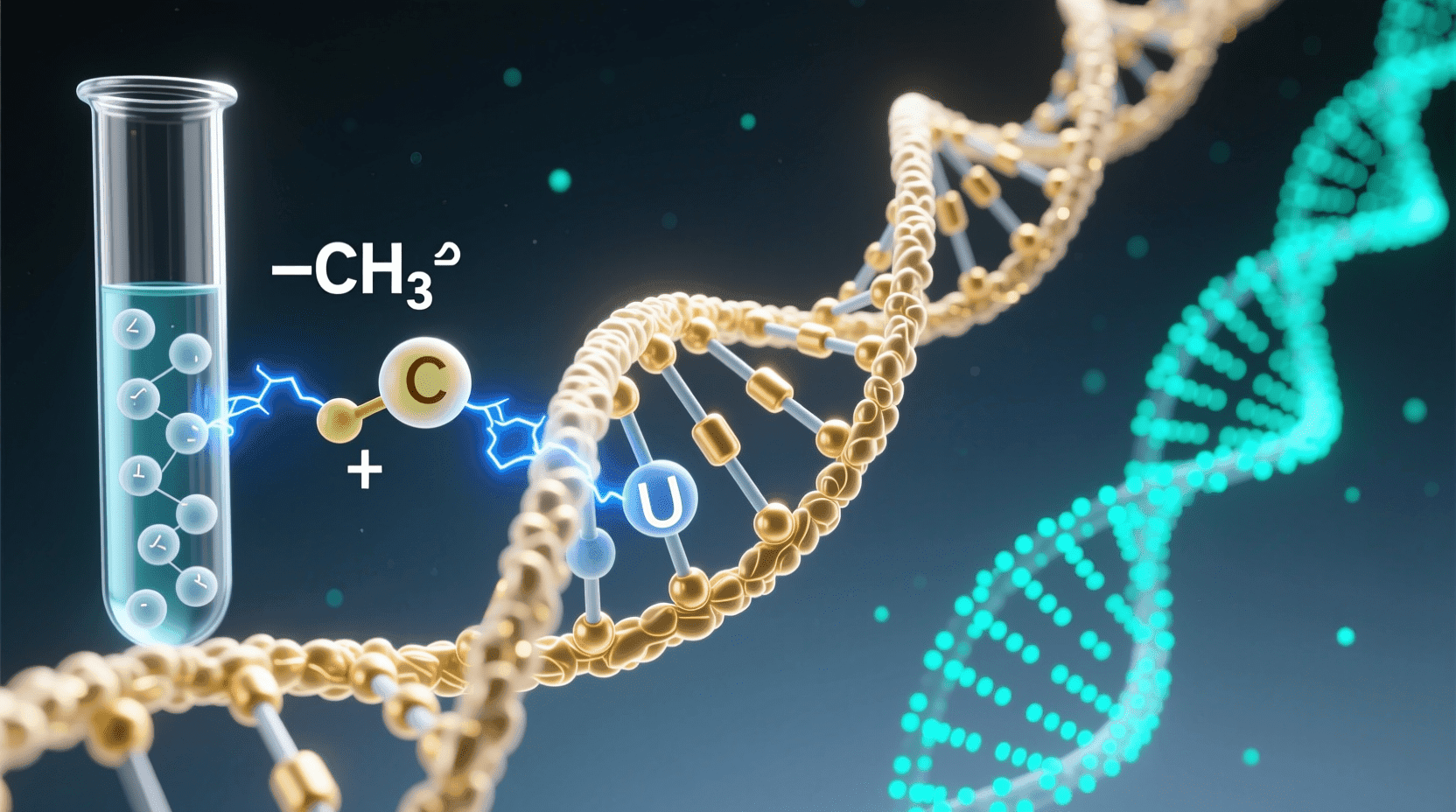
这种方法的巧妙之处在于能够将表观遗传信息转化为遗传信息。亚硫酸氢盐是一种化学试剂,它有一个特殊的能力:只能将未被甲基化的胞嘧啶转化为尿嘧啶,而对甲基化的胞嘧啶“视而不见”。
亚硫酸氢盐处理是目前检测DNA甲基化最准确的方法,被认为是甲基化检测的“金标准”。
复旦大学附属肿瘤医院的研究团队利用这种方法,建立了一套适合中国人群的结直肠癌早期筛查体系,通过检测粪便DNA中特定基因的甲基化状态,可以提前发现癌前病变。
甲基化特异性PCR技术
甲基化特异性PCR(MSP)是基于亚硫酸氢盐处理的进一步发展。这种方法设计两套引物:一套专门识别甲基化的DNA序列,另一套专门识别非甲基化的序列。就像制作两把不同的钥匙,每把钥匙只能打开对应的锁。
清华大学生命科学学院的研究人员使用这种技术,发现了调控小鼠胚胎发育过程中基因表达的关键甲基化开关,这一发现对理解人类胚胎发育异常具有重要意义。
联合亚硫酸氢盐限制性分析
联合亚硫酸氢盐限制性分析(COBRA)结合了亚硫酸氢盐处理和限制性酶切的优点。这种方法首先用亚硫酸氢盐处理DNA,然后用限制性酶切割,最后通过电泳分析结果。
中国农业大学的科研团队利用COBRA技术,研究了小麦在盐胁迫条件下的甲基化变化,发现了一批与耐盐性相关的基因,为培育耐盐小麦品种提供了理论基础。
全基因组检测技术
甲基化敏感扩增多态性分析(MSAP)
甲基化敏感扩增多态性(MSAP)分析是一种高通量、经济实用的全基因组甲基化检测方法。它的原理是在限制性内切酶HpaII和MspI(一对同工酶)对DNA切割敏感性的基础上,通过PCR扩增和片段分析来判断DNA中某一位点的甲基化状态。HpaII和MspI能辨别甲基化和非甲基化的CCGG位点,从而使MSAP能够检测基因组中大量位点的甲基化多态性。
MSAP的流程主要包括以下几个步骤:首先提取目标生物基因组DNA,分别用甲基化敏感的HpaII和不敏感的MspI消化,然后连接接头,使用接头特异性引物进行PCR扩增。扩增产物随后通过聚丙烯酰胺凝胶电泳或毛细管电泳分析,获得基因组不同区域的甲基化“指纹”。
相比传统的点检测方法,MSAP能够一次性扫描整个基因组的成千上万个位点,系统性反映甲基化整体分布和差异。它适用于动植物、真菌等多种生物的甲基化研究,尤其适合野生群体、自然群体或无参考基因组的物种。
华中农业大学的科学家们利用MSAP技术,深入研究了水稻在高盐、干旱和低温等不同环境胁迫条件下的表观遗传学变化。他们发现,环境胁迫能够迅速引发大量基因的甲基化和去甲基化调整,而这些调整并非随机,而是具有一定的可遗传性,一部分甲基化变化能够遗传给后代。这揭示了甲基化作为植物适应环境变化的重要分子机制。除了水稻,MSAP还被广泛应用于小麦、玉米、棉花等主要农作物的遗传育种研究中,帮助科学家筛选与逆境耐受性、产量调控等性状相关的新基因位点。
MSAP的显著优点是其高通量、经济、无需参考序列,并且适合野外或复杂群体样品的大规模筛查。但它也存在一些限制:只能检测CCGG位点的甲基化,而无法反映其他甲基化类型;检测分辨率相对较低,且部分片段区分能力有限。
高效液相色谱检测(HPLC)
高效液相色谱(HPLC)检测是定量分析全基因组DNA甲基化水平的“黄金标准”之一。其原理是先将提取得到的基因组DNA在高温下完全水解为单核苷酸,然后采用液相色谱对甲基化胞嘧啶(5-mC)和未甲基化胞嘧啶(C)进行分离和检测,通过峰面积比值准确计算样品中的甲基化含量。
HPLC的出色之处在于其高精度与良好的重现性,能够灵敏检测出相对较低或细微的甲基化水平变化。鉴于其无须引物、探针或序列信息,HPLC具有极好的适用广泛性和定量准确性。不过,它不能分辨甲基化修饰分布在基因组的具体区域,因此不能为甲基化定位或特异性研究提供信息。
北京理工大学的研究团队,采用HPLC检测了不同年龄段中国人群外周血中基因组DNA的全局甲基化水平,系统揭示了人类甲基化水平随年龄增长呈下降趋势,这为阐释衰老相关分子机制和疾病风险评估提供了基础数据。此外,HPLC也常被用于动物、植物以及环境微生物的群体甲基化状况监测,为农业遗传改良与医疗健康研究提供支持。
HPLC的优点包括高度的灵敏性、精确性和可重复性,非常适合全基因组范围“大样本量”定量分析。缺点是无法定位到单一基因或区域,适合观察总体甲基化变化趋势,不适用于高分辨率定位研究。
甲基化DNA免疫共沉淀技术(MeDIP)
甲基化DNA免疫共沉淀(MeDIP)是一种利用特异性抗体富集甲基化DNA片段的高效方法,被形象地比喻为用“磁铁”把甲基化DNA从复杂的基因组“吸”出来。MeDIP的基本操作流程包括:将样品DNA断片化,加入能识别5-甲基胞嘧啶(5mC)的抗体进行孵育,使甲基化片段与抗体结合,随后通过免疫共沉淀过程将这些片段富集出来,最后进行后续qPCR、微阵列杂交或高通量测序分析。
MeDIP最大的特点在于灵活与兼容多种下游分析,可以实现甲基化区域的定性和定位,尤其与芯片(MeDIP-chip)、测序(MeDIP-seq)结合后,能够在全基因组范围内快速绘制甲基化图谱。与亚硫酸氢盐测序等化学方法相比,MeDIP操作简便、对DNA质量要求较宽松,特别适合处理大量样本。
西北农林科技大学利用MeDIP-seq技术,系统分析了苹果果实发育各时期的基因组甲基化动态。他们不仅构建了完整的发育阶段甲基化图谱,还发现一批关键调控果实成熟和品质的甲基化基因,这一成果推动了果树分子育种和品质改良研究。同样,MeDIP在植物抗逆性、动物发育甚至肿瘤甲基化标志物的研究中均有广泛应用。
MeDIP的优点是适合全基因组范围筛查、兼容不同下游应用、可用于片段化DNA且操作效率高。但它对于低丰度或局部弱甲基化区域的灵敏度不足,部分短片段或高GC区域容易富集偏倚。
检测方法选择综合比较
组蛋白修饰研究方法
染色质免疫共沉淀技术
染色质免疫共沉淀(ChIP)技术是研究组蛋白修饰的“金标准”方法。这项技术利用特异性抗体富集携带特定修饰(如乙酰化、甲基化等)的组蛋白-DNA复合物,然后分离出与之结合的DNA,进行后续分析,以揭示染色质修饰在基因表达调控中的作用。ChIP被形象地比喻为给DNA和蛋白质拍“合影”,并通过抗体“拉”出感兴趣的修饰片段。
ChIP实验对抗体质量要求极高,抗体的特异性直接决定实验结果的可靠性。建议选择经过验证的商业化抗体,避免使用未经验证的抗体。
随着ChIP-seq等高通量方法的出现,ChIP技术已广泛应用于哺乳动物、植物甚至酵母等物种组蛋白修饰图谱的构建,推动了表观遗传领域的精细解析。上海交通大学医学院的团队应用ChIP技术,发现中国汉族人群中某些与糖尿病易感性相关基因的启动子区域存在特异的组蛋白修饰模式,为糖尿病等复杂疾病的个性化治疗研究提供了新思路。
ChIP实验的关键步骤与技巧
ChIP实验具有一定技术难度,每一步操作对最终结果影响重大,常见流程要点如下:
技术人员应特别关注溶液纯净度、剪切均一性和样本批次间一致性,以提升实验重复性。近年来还发展出了如ChIPmentation、CUT&RUN等更简便的新技术,为低量样本、单细胞等精细研究提供了可能。
技术选择与应用指导
选择合适的检测方法就像选择合适的交通工具一样,需要综合考虑研究的最终目标、样本类型、实验条件、预算投入、时间安排等多个因素。如果仅注重某一方面,忽视了其他条件限制,极易导致方案不佳或资源浪费。不同表观遗传学检测技术各有所长,适合回答不同的科学问题。
实验方法选择错误是导致研究失败的主要原因之一。在开始实验前,务必根据研究目标、样本类型、预算限制、实验环境和操作能力等多个因素综合权衡。建议优先充分查阅文献、咨询有经验的同行或平台技术人员,确保选用最适合的检测技术方案。
不同研究目的的方法推荐
对于不同的表观遗传学研究情境,以下方法更具针对性和优势:
随着技术发展,越来越多的综合性和专用型方法涌现,例如多组学联合检测、靶向富集与全基因组技术结合等。在方案设计阶段,要结合自身实验平台的能力、后续数据分析的可及性,以及样本特异性,合理选择或整合方法。
部分方法的具体应用
- 甲基化特异性PCR(MSP)/甲基化限制性酶切分析(COBRA) 适用于样本量较小、需要强验证性的实验,如疾病相关基因功能的分析。
- 亚硫酸氢盐测序(BS-seq) 分辨率最高,但数据量大、分析难度高,适合需要深入机制研究、经费支持充足的课题。
- 甲基化免疫沉淀测序(MeDIP-seq) 在覆盖范围和成本之间达到较好平衡,适合筛查新的甲基化调控线索。
- 甲基化敏感性扩增多态性分析(MSAP) 更适用于植物的全基因组水平研究或育种筛选。
- 单细胞相关表观遗传技术 对起始样本量和操作技术要求较高,但可以探索以往难以揭示的复杂生物学问题。
成本效益分析
不同方法的原理复杂度、试剂耗材耗费、人力需要和数据分析开销差别显著。以检测10个样本为例,各法的投入差异如下表所示(为便于参考,实际成本受具体实验条件影响):
注意事项:
- BS测序和MeDIP除实验成本外,数据分析所需软/硬件资源和人员培训不容忽视。
- 设备条件不足时,可考虑委托检测(如外包服务),性价比可能更高。
- 部分通用设备(如PCR仪、电泳仪)可支持多种检测方法。
此外,实际项目常常需要灵活组合多种方法。例如,先用MSP筛选,再用BS-seq确证细节,能够有效兼顾成本和数据深度。
前沿发展趋势
表观遗传学领域正在经历爆发式发展,新技术层出不穷,为科学家们提供了前所未有的研究工具和信息维度。
单细胞表观遗传学技术
传统检测方法往往获得的是“群体平均值”,难以反映单个细胞的真实状态。单细胞技术则如同放大镜,让我们得以“逐棵树”而不是“看整片森林”。
近年来,中国科学院北京基因组研究所开发的单细胞甲基化测序技术(scBS-seq、scWGBS等)已应用于人类胚胎发育、肿瘤进化追踪等前沿研究,揭示了细胞命运转换和早期疾病起源背后的表观遗传机制,为精准医学奠定理论基础。
单细胞表观遗传学已经成为全球研究的热点,其与单细胞转录组、蛋白组等方法的联合,有望揭开细胞发育、肿瘤异质性、免疫微环境等复杂生物学过程的机制图谱。未来,检测通量、数据质量和降本增效将进一步推动其临床与基础研究的突破。
长读长测序技术的应用
长读长测序(如PacBio、Oxford Nanopore等),相比传统短读长测序,能够一次性读出几千至上百万碱基片段。其最大优势是无需拼接,直接穿越重复和复杂结构,可覆盖全基因组的难测区域。华大基因与中科院等合作已用该技术解析了小麦等大基因组的甲基化分布,发现了调控产量和抗逆性的新区域,对于作物分子育种、复杂疾病研究带来巨大价值。
同时,长读长测序平台开始支持直接检测甲基化及部分组蛋白修饰,实现了多组分、全景式的表观遗传信息获取。
人工智能在表观遗传学中的应用
随着高通量数据剧增,传统人工分析已难胜任。人工智能,尤其是深度学习和机器学习模型,正快速渗透数据处理流程。清华大学计算生物学实验室开发的深度神经网络,已经能够利用原始DNA序列或组学信息自动识别甲基化状态和修饰模式,准确率高达90%+。AI不仅大幅提高分析效率,还推动了甲基化预测、转录调控网络重建、疾病预警等创新应用。未来,AI与自动化实验流水线结合,有望实现表观遗传信息的“实时采集与智能解读”。
整体来看,表观遗传学已经从“基因甲基化”发展到“多组分、多尺度、多层级联合解读”的新阶段,为我们理解生命现象、疾病机制、生物改良与临床诊断提供了前所未有的工具箱。未来,数据整合、自动化与大数据智能分析将成为推动表观遗传学飞速演进的三大驱动力。
学习表观遗传学检测技术的门槛并不高,关键在于夯实基本原理、理解方法适用性、注重实验操作。建议初学者可以从MSRE/MSP等简单方法入门,积累实验和分析经验,再逐步挑战BS测序、单细胞等高端技术,最终能够灵活应对复杂课题。
不论是基础科学还是临床转化,正确选择合适的检测方法,合理规划实验与分析流程,都是取得创新成果和提升竞争力的关键。希望本指南能够帮助更多初学者和科研人员理清表观遗传学技术的逻辑脉络,勇敢拓展创新思路,共同推动中国乃至全球表观遗传学研究与应用高质量发展。