病毒的结构与复制

病毒作为一种独特的生命形式,长期以来一直是微生物学研究的核心对象。不同于细菌和真菌这类能够独立进行新陈代谢和繁殖的生物,病毒自身并不具有完整的生命活动系统。它们必须寄生在宿主细胞内,利用宿主的酶和能量合成体系才能进行复制和扩散。因此,从严格意义上说,病毒被认为处于生物与非生物的边界。
随着分子生物学和显微技术的进步,人类对病毒的认识日益深入。例如,19世纪末人类首次发现病毒,揭示了存在一种比细菌更小、能够过滤通过的致病因子。现代病毒学不仅关注病毒本身的结构和生命周期,还研究它与宿主之间的相互作用,包括如何入侵细胞、逃避免疫、以及如何引发宿主的疾病反应。
病毒对人类社会的影响巨大且深远。从2003年的SARS疫情到2009年的甲型H1N1流感,以及2020年爆发的新冠肺炎疫情,新型病毒的出现一再挑战公共卫生体系,并且促使科学界不断探索新型检测、防控和治疗手段。除此之外,病毒还广泛分布于自然界,对生态系统的平衡和进化具有重要作用。例如,在海洋生态系统中,病毒通过调节海洋微生物种群,影响着全球碳循环和营养物质流动。
深入理解病毒的结构特征,如其衣壳、包膜、遗传物质种类等,以及其独特的复制机制,是掌握病毒性疾病预防控制策略的基础。只有全面把握病毒赖以生存和繁衍的分子机制,才能更有效地研发针对性的疫苗、抗病毒药物和快速检测方法,提高人类抵御病毒威胁的能力。这些前沿知识不仅在医疗卫生领域有重大意义,也为生物技术、农业、环境科学等多个领域的发展提供了理论和实践基础。
病毒的基本特征与分类
病毒的发现可以追溯到19世纪末,当时俄国科学家伊万诺夫斯基在研究烟草花叶病时,发现致病因子能够通过细菌滤器。这种比细菌更小的感染性物质后来被命名为病毒。在中国,病毒学研究起步于20世纪初,汤飞凡教授在1955年首次分离出沙眼衣原体,开创了中国病毒学研究的先河。
病毒的基本特征使其在生物界中占据独特的地位。病毒的大小通常在20至300纳米之间,远小于细菌。以新型冠状病毒为例,其直径约为100纳米,相当于一根头发丝直径的千分之一。这种微小的尺寸使得病毒必须借助电子显微镜才能观察到其形态结构。
病毒是介于生命与非生命之间的物质形式,在宿主细胞外表现为没有生命特征的化学大分子,而在宿主细胞内则表现出生命活动的特征。
病毒的化学组成相对简单,核心部分是遗传物质,外面包裹着蛋白质外壳。遗传物质可以是DNA或RNA,但不会同时含有两种核酸。这一特点成为病毒分类的重要依据。中国科学家在病毒分类学研究中做出了重要贡献,特别是在植物病毒和昆虫病毒的分类研究方面。
根据遗传物质的类型和结构特征,病毒可以划分为多个类别。巴尔的摩分类系统是目前国际上广泛使用的病毒分类方法,该系统根据病毒基因组的类型将病毒分为七大类。这种分类方法不仅考虑了病毒的遗传物质类型,还考虑了其复制策略。
除了按遗传物质分类外,病毒还可以根据宿主类型进行划分。动物病毒、植物病毒和细菌病毒(噬菌体)各具特色。在中国农业生产中,植物病毒病一直是影响作物产量的重要因素。例如,水稻条纹叶枯病毒和番茄黄化曲叶病毒都曾在不同地区造成严重的经济损失。
病毒的结构组成与形态
病毒的结构虽然简单,但其组织方式却十分精巧。最基本的病毒颗粒称为病毒体,由核酸和蛋白质外壳组成。蛋白质外壳称为衣壳,由许多相同或相似的亚单位蛋白质(壳粒)按照特定的几何对称方式组装而成。这种对称的结构不仅节省了遗传信息的编码空间,还提高了病毒颗粒的稳定性。

病毒的形态类型主要有三种基本模式。螺旋对称病毒的衣壳蛋白围绕核酸螺旋排列,形成棒状或丝状结构。烟草花叶病毒是最早被研究的螺旋对称病毒之一,其长度约为300纳米,直径约为18纳米。在中国的烟草种植区,这种病毒曾经造成严重的经济损失,通过抗病品种的培育和栽培管理措施的改进,目前已经得到有效控制。
二十面体对称是病毒中最常见的结构类型。这种结构由20个等边三角形面组成,具有最大的内部空间和最小的表面积比例。腺病毒、脊髓灰质炎病毒和新型冠状病毒都采用这种对称方式。二十面体结构的稳定性使得病毒能够在环境中保持感染性。
复合对称病毒结合了螺旋对称和二十面体对称的特点,结构最为复杂。T4噬菌体是研究最透彻的复合对称病毒,其头部呈二十面体结构,尾部为螺旋对称。这种精密的结构使得噬菌体能够准确识别和侵染细菌细胞。
某些病毒在衣壳外还包裹着一层脂质双层膜,称为包膜。包膜来源于宿主细胞的质膜、内质网膜或核膜,其中镶嵌着病毒编码的糖蛋白。这些糖蛋白不仅参与病毒对宿主细胞的识别和吸附,还是宿主免疫系统识别的主要抗原。新型冠状病毒表面的刺突蛋白(S蛋白)就是一种包膜糖蛋白,它与人体细胞表面的ACE2受体结合,介导病毒进入细胞。
包膜病毒对环境的抵抗力通常较弱,容易被消毒剂和洗涤剂破坏,这也是为什么用肥皂洗手能有效预防新冠病毒感染的科学原理。
病毒蛋白质的功能十分多样。结构蛋白构成病毒颗粒的骨架,非结构蛋白则在病毒复制过程中发挥酶的作用。以流感病毒为例,其包膜上的血凝素和神经氨酸酶是两种重要的糖蛋白,前者负责病毒吸附和侵入细胞,后者帮助新合成的病毒颗粒从细胞中释放。抗流感药物奥司他韦正是通过抑制神经氨酸酶的活性来阻止病毒传播。
病毒的复制周期
病毒的复制是一个高度有序的过程,必须在活细胞内完成。整个复制周期可以分为几个连续的阶段,每个阶段都涉及病毒与宿主细胞之间复杂的相互作用。理解这些过程对于开发抗病毒药物具有重要意义。
病毒复制的第一步是吸附。病毒通过其表面的特定蛋白质识别宿主细胞表面的受体分子。这种识别具有高度的特异性,决定了病毒的宿主范围和组织嗜性。新型冠状病毒主要感染表达ACE2受体的细胞,这些细胞主要分布在肺泡上皮、肠道上皮和血管内皮。病毒与受体的结合就像钥匙和锁的关系,只有结构匹配才能完成吸附。
吸附完成后,病毒需要将其遗传物质导入宿主细胞。不同类型的病毒采用不同的侵入方式。包膜病毒通常通过膜融合的方式进入细胞,病毒包膜与细胞膜融合,将病毒核心释放到细胞质中。无包膜病毒则可能通过内吞作用进入细胞,在内体中脱去衣壳后释放核酸。
病毒核酸进入细胞后,便开始了复制阶段。DNA病毒通常在细胞核内复制,利用宿主细胞的DNA聚合酶和转录系统合成新的病毒核酸和蛋白质。RNA病毒大多在细胞质中复制,需要携带自己的RNA复制酶。正链RNA病毒的基因组可以直接作为mRNA翻译出病毒蛋白质,而负链RNA病毒则需要首先合成互补的正链RNA。
逆转录病毒的复制机制最为特殊。以人类免疫缺陷病毒(HIV)为例,其RNA基因组进入细胞后,通过逆转录酶合成DNA拷贝,然后整合到宿主染色体中。整合的病毒DNA称为前病毒,可以随着宿主细胞的分裂而复制,长期潜伏在细胞中。这种特性使得HIV感染难以彻底清除。
病毒蛋白质和核酸合成完成后,需要组装成完整的病毒颗粒。组装过程具有自组装的特性,病毒蛋白质能够自发地按照特定的方式聚集并包装核酸。这一过程不需要额外的能量输入,完全依赖于蛋白质分子间的相互作用力。在某些情况下,衣壳蛋白先形成空的衣壳,然后将核酸包装进去;而在另一些情况下,衣壳蛋白边组装边包装核酸。
最后,新合成的病毒颗粒需要从细胞中释放。无包膜病毒通常通过裂解宿主细胞的方式释放,导致细胞死亡。包膜病毒则采用出芽的方式释放,病毒颗粒被宿主细胞膜包裹后从细胞表面脱落。这种方式对宿主细胞的损伤相对较小,使得病毒能够持续产生而不立即杀死宿主细胞。
病毒复制周期中的每一个环节都可能成为抗病毒药物的靶点。例如,抗HIV药物根据作用机制分为逆转录酶抑制剂、蛋白酶抑制剂和整合酶抑制剂等多种类型。
噬菌体的生物学特性
噬菌体是感染细菌的病毒,其数量在自然界中极其庞大。据估计,海洋中噬菌体的总数超过10的31次方,比细菌的数量还要多10倍。噬菌体在调节细菌种群数量、促进基因水平转移以及维持生态平衡方面发挥着重要作用。
T4噬菌体是研究最为深入的噬菌体之一。其结构包括头部、尾部和尾丝三个部分。头部呈二十面体,内含双链DNA;尾部是一个中空的管状结构,外面包裹着收缩性的尾鞘;尾部末端连接着基板和尾丝,用于识别和吸附细菌。这种精密的结构使得T4噬菌体能够像注射器一样将DNA注入细菌细胞。
噬菌体的生活周期分为裂解性循环和溶原性循环两种类型。在裂解性循环中,噬菌体感染细菌后立即开始复制,最终导致细菌裂解死亡并释放出大量子代噬菌体。整个过程通常在20至30分钟内完成。以T4噬菌体为例,一个细菌被感染后可以释放出100至300个新的噬菌体颗粒。
溶原性循环的过程则更为复杂。温和噬菌体(如λ噬菌体)感染细菌后,其DNA整合到细菌染色体中,成为前噬菌体。前噬菌体随着细菌染色体的复制而复制,并通过细菌的分裂传递给子代细胞。在这种状态下,噬菌体基因处于抑制状态,不产生子代病毒颗粒,细菌也能正常生长繁殖。
当溶原性细菌受到紫外线照射、化学诱变剂处理或其他环境压力时,前噬菌体可以被激活,从细菌染色体上切离下来,转入裂解性循环。这种转换机制使得噬菌体能够根据环境条件选择最有利的生存策略。当宿主细菌生长条件良好时,噬菌体以溶原状态共生;当环境恶化时,噬菌体则通过裂解性循环扩散到新的宿主。
中国科学家在噬菌体应用研究方面取得了显著成果。华大基因研究院在2019年成功分离出多株能够裂解耐药性金黄色葡萄球菌的噬菌体,为治疗耐药菌感染提供了新思路。随着抗生素耐药性问题日益严重,噬菌体疗法重新受到关注。噬菌体具有高度的特异性,只攻击特定的细菌而不影响正常菌群,这一特点使其在精准治疗方面具有独特优势。
除了医疗应用,噬菌体在食品工业和农业生产中也发挥着重要作用。在奶制品生产中,噬菌体感染发酵乳酸菌会导致发酵失败,造成经济损失。因此,乳品企业需要建立噬菌体监测体系,定期更换发酵菌株以避免噬菌体污染。在农业方面,噬菌体可以用于防治植物细菌性病害,如番茄青枯病和柑橘溃疡病。
病毒与疾病防控
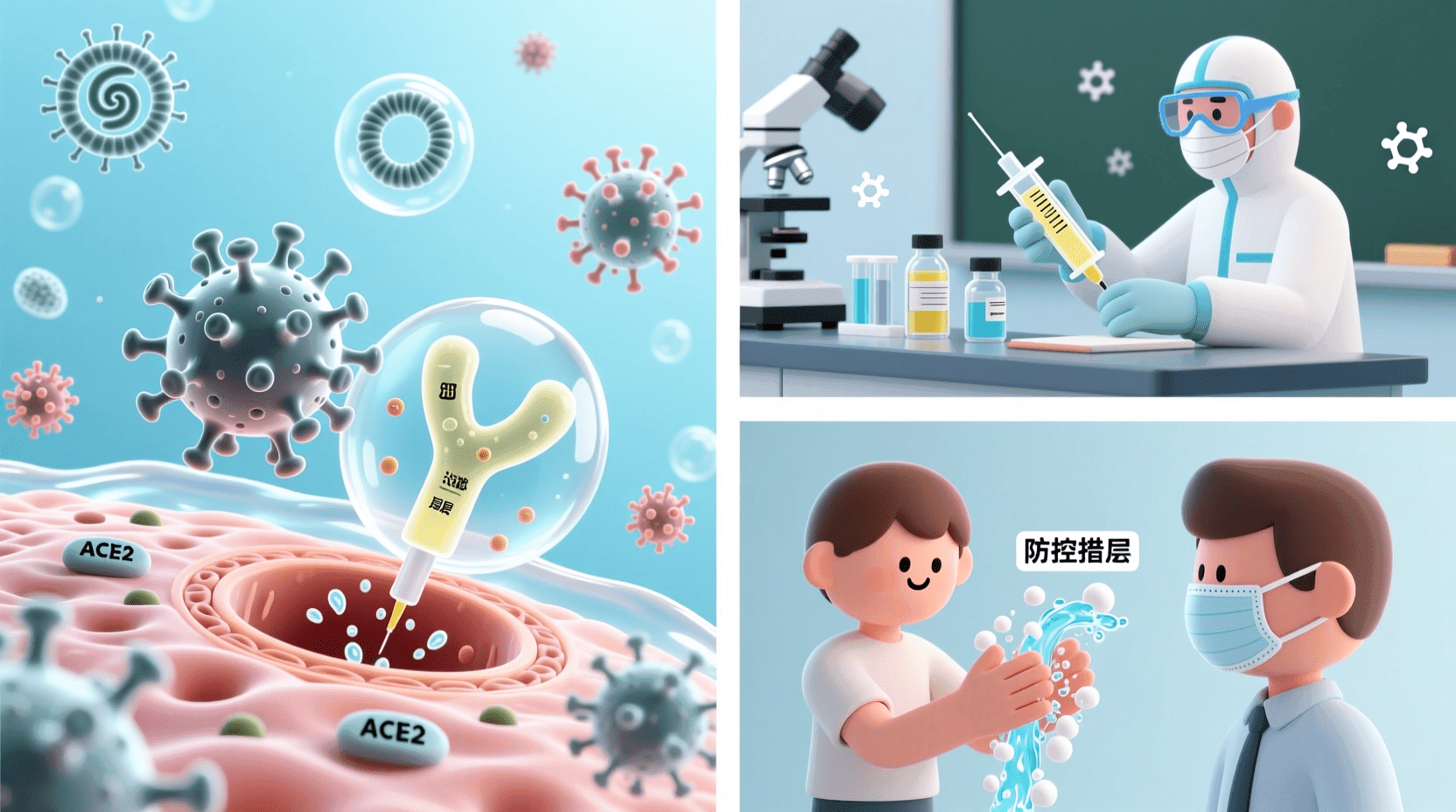
病毒性疾病的防控是公共卫生领域的重要课题。从天花的根除到新冠疫情的控制,人类与病毒的斗争从未停止。理解病毒的传播机制和致病原理是制定有效防控策略的基础。
病毒的传播途径多种多样,不同的病毒有不同的传播方式。呼吸道病毒主要通过飞沫和气溶胶传播,流感病毒和新型冠状病毒都属于这一类。肠道病毒通过粪-口途径传播,脊髓灰质炎病毒和诺如病毒是典型代表。血液传播病毒如HIV和乙型肝炎病毒主要通过血液和体液接触传播。虫媒病毒则需要蚊虫等节肢动物作为传播媒介,登革热病毒和乙型脑炎病毒都通过蚊子叮咬传播。
病毒致病的机制包括直接损伤和免疫病理损伤两个方面。直接损伤是指病毒在宿主细胞内复制导致细胞功能障碍和死亡。例如,流感病毒感染呼吸道上皮细胞后,细胞裂解释放大量病毒颗粒,造成上皮损伤和炎症反应。免疫病理损伤则是由宿主免疫系统对病毒感染的过度反应引起的。新冠重症患者出现的“细胞因子风暴”就是一种免疫病理损伤,过度激活的免疫细胞释放大量炎症因子,导致多器官损伤。
中国在病毒性疾病防控方面积累了丰富经验。从2003年SARS疫情中建立的传染病直报系统,到新冠疫情期间快速研发的多种疫苗,都展现了中国公共卫生体系的建设成果。
疫苗接种是预防病毒性疾病最有效的手段。疫苗的原理是通过引入减毒或灭活的病毒,或者病毒的某些成分,刺激机体产生特异性免疫应答,使机体获得对该病毒的免疫力。传统疫苗包括减毒活疫苗和灭活疫苗。减毒活疫苗使用经过减毒处理的病毒株,保留了病毒的免疫原性但降低了致病性,麻疹疫苗和水痘疫苗属于这一类。灭活疫苗使用经过物理或化学方法杀死的病毒,狂犬病疫苗和甲型肝炎疫苗采用这种技术。
新型疫苗技术的发展为病毒性疾病防控提供了新的工具。重组蛋白疫苗通过基因工程技术生产病毒的特定蛋白质作为抗原,乙型肝炎疫苗和人乳头瘤病毒(HPV)疫苗都是成功的例子。病毒载体疫苗利用无害的病毒作为载体,携带目标病毒的基因进入人体细胞表达抗原。核酸疫苗(DNA疫苗和mRNA疫苗)直接将编码病毒抗原的核酸导入人体细胞,由细胞自身合成抗原蛋白。新冠mRNA疫苗的成功应用标志着疫苗技术的重大突破。
抗病毒药物的研发是病毒性疾病治疗的另一个重要方向。与抗生素不同,抗病毒药物的开发面临更大的挑战,因为病毒依赖宿主细胞的代谢系统进行复制,针对病毒的药物容易对宿主细胞产生毒性。目前成功的抗病毒药物主要针对病毒复制周期中的特定环节。核苷类似物是最早开发的抗病毒药物,通过模拟天然核苷酸掺入病毒核酸,终止病毒核酸链的延伸。阿昔洛韦用于治疗疱疹病毒感染,齐多夫定是第一个批准用于治疗HIV感染的药物。
蛋白酶抑制剂通过阻断病毒蛋白质的加工成熟来抑制病毒复制。HIV蛋白酶抑制剂和丙型肝炎病毒蛋白酶抑制剂都取得了显著的临床效果。神经氨酸酶抑制剂如奥司他韦能够阻止流感病毒从宿主细胞释放,减少病毒传播。新冠疫情期间,中国科学家筛选出多种具有抗新冠病毒活性的化合物,包括中药提取物和化学合成药物。
除了疫苗和药物,综合防控措施在控制病毒传播中同样重要。个人防护包括佩戴口罩、勤洗手、保持社交距离等简单但有效的措施。环境消毒能够减少病毒在物体表面的存活时间。病例监测和流行病学调查有助于及时发现和隔离感染者,切断传播链。中国在新冠疫情防控中采用的“动态清零”策略,就是通过多种措施的综合运用,将疫情控制在最低水平。
小结
本内容系统介绍了病毒的基本特征、结构组成、复制机制以及与人类疾病的密切关系。病毒虽然结构极其简化,仅由遗传物质和蛋白质(有些还有包膜)组成,但却展现出惊人的复制速度和适应能力。病毒不仅能感染动物、植物和微生物,还在生态系统中扮演着重要的角色。例如,噬菌体调控细菌种群平衡,某些植物病毒可影响农作物产量。现代医学研究已经证明,病毒感染是多种重大疾病(如艾滋病、肝炎、流感和新冠肺炎)发生和流行的根本原因之一。
理解病毒的生物学特性和侵染机制,对于制定有效的病毒性疾病防控策略具有基础性意义。病毒与宿主细胞之间的“攻防战”,不仅推动了免疫学和分子生物学的发展,还促进了疫苗、抗病毒药物和诊断技术的不断创新。随着分子生物学和基因工程技术的进步,病毒学研究已由传统的形态学、生理学研究,发展为高度精准的分子层面解析。例如,mRNA疫苗、基因治疗和病毒溯源等领域,都以病毒学为理论基石,极大地推动了现代医疗和公共卫生事业的进步。
此外,病毒的进化和变异速度极快,这使得病毒与人类的斗争呈现长期性和复杂性。例如,流感病毒和新型冠状病毒频繁出现变异株,给全球疾病防控带来巨大挑战。这也提醒我们,疫情防控不只是医学问题,还涉及社会、经济、国际协作等方方面面。
随着人类对病毒的深入研究,病毒学正在成为精准医学、基因工程、合成生物学等前沿领域的重要组成部分。病毒因其独特的生物学属性,也越来越多地被应用于科学研究和生物技术实践,比如用作基因输送载体、癌症治疗工具等。
下一部分中我们将学习微生物的遗传与变异,探讨微生物如何通过遗传物质的改变来适应环境变化,并理解这些变化如何影响疾病流行和生物技术的发展。
本节练习
1. 以下关于病毒基本特征的描述,哪一项是正确的?
A. 病毒同时含有DNA和RNA两种核酸
B. 病毒可以在人工培养基上独立生长
C. 病毒的大小通常在20至300纳米之间
D. 所有病毒都具有包膜结构
答案:C
解析: 病毒只含有一种核酸(DNA或RNA),不能同时含有两种,因此A错误。病毒是专性细胞内寄生物,必须在活细胞内才能复制,不能在人工培养基上独立生长,B错误。病毒的大小确实通常在20至300纳米之间,C正确。并非所有病毒都有包膜,有些病毒只有衣壳而没有包膜,如脊髓灰质炎病毒,D错误。这道题考查病毒的基本特征,特别是病毒的大小范围和核酸组成。
2. 新型冠状病毒属于巴尔的摩分类系统的哪一类?
A. I类(双链DNA病毒)
B. IV类(正链单链RNA病毒)
C. V类(负链单链RNA病毒)
D. VI类(逆转录病毒)
答案:B
解析: 新型冠状病毒的遗传物质是正链单链RNA,其基因组RNA可以直接作为mRNA指导蛋白质合成,属于巴尔的摩分类系统的IV类。I类是双链DNA病毒如疱疹病毒,V类是负链单链RNA病毒如流感病毒,VI类是需要逆转录的RNA病毒如HIV。这道题考查病毒分类知识以及对新冠病毒遗传物质特性的理解。
3. T4噬菌体侵染细菌的过程中,首先进入细菌细胞的成分是?
A. 噬菌体的全部结构
B. 噬菌体的DNA
C. 噬菌体的蛋白质外壳
D. 噬菌体的尾部结构
答案:B
解析: T4噬菌体通过尾部吸附在细菌细胞壁上后,尾鞘收缩,将DNA从尾管注入细菌细胞内,而蛋白质外壳留在细菌细胞外。这是病毒侵染的经典实验证据,也是赫尔希和蔡斯通过同位素标记实验证明DNA是遗传物质的基础。因此只有DNA进入细菌细胞,蛋白质外壳留在外面。这道题考查噬菌体侵染细菌的过程和机制。
4. 关于病毒复制周期中的潜伏期,以下说法正确的是?
A. 潜伏期内可以检测到大量游离病毒颗粒
B. 潜伏期是病毒吸附和侵入细胞的阶段
C. 潜伏期内病毒正在进行核酸和蛋白质的合成
D. 潜伏期越长,产生的子代病毒数量越少
答案:C
解析: 病毒复制的潜伏期是指从病毒侵入细胞到释放出第一个子代病毒颗粒之间的时间。在这个阶段,细胞外检测不到游离的病毒颗粒,因为病毒正在细胞内进行核酸复制、蛋白质合成和组装,A错误。吸附和侵入发生在潜伏期之前,B错误。潜伏期的长短与子代病毒数量没有直接关系,D错误。这道题考查对病毒复制周期各阶段特征的理解。
5. 包膜病毒对以下哪种处理最敏感?
A. 低温冷冻
B. 酒精消毒
C. 紫外线照射
D. 高压灭菌
答案:B
解析: 包膜病毒的包膜由脂质双层构成,酒精等脂溶性溶剂能够溶解脂质膜,破坏病毒结构,使其失去感染性。这就是为什么75%酒精能有效灭活新冠病毒的原因。低温冷冻反而有利于病毒保存,A错误。紫外线照射主要破坏核酸而非包膜,C不是最敏感的。高压灭菌虽然有效但不是包膜病毒特别敏感的处理方法,D错误。这道题考查包膜病毒的结构特点和消毒原理。
6. 请解释为什么说病毒是“介于生命与非生命之间”的存在,并说明病毒复制为什么必须依赖宿主细胞。
答案要点:
病毒被认为介于生命与非生命之间,主要基于以下特点:在宿主细胞外,病毒表现为无生命特征的化学大分子复合体,不进行代谢活动,不生长繁殖,可以结晶保存;而在宿主细胞内,病毒能够利用宿主的代谢系统进行复制,产生子代病毒,表现出生命活动的特征。
病毒复制必须依赖宿主细胞的原因包括:第一,病毒缺乏完整的代谢系统,没有核糖体、线粒体等细胞器,无法独立合成蛋白质和产生能量;第二,病毒的遗传信息有限,只编码少量与复制相关的蛋白质,需要借用宿主细胞的转录、翻译系统;第三,病毒需要宿主细胞提供核苷酸、氨基酸等原材料用于合成病毒核酸和蛋白质;第四,病毒的组装和释放也需要利用宿主细胞的膜系统和运输机制。因此,病毒是专性细胞内寄生物,离开活细胞就无法进行生命活动。
7. 比较噬菌体的裂解性循环和溶原性循环,说明这两种生活周期对噬菌体适应环境变化的意义。
答案要点:
裂解性循环和溶原性循环的主要区别体现在以下方面:裂解性循环中,噬菌体感染细菌后立即启动复制程序,在短时间内大量复制并导致细菌裂解死亡,释放大量子代噬菌体;溶原性循环中,噬菌体DNA整合到细菌染色体中成为前噬菌体,随细菌复制和分裂而传递,不产生子代病毒颗粒,细菌保持存活。
这两种生活周期的生态学意义在于:当环境条件适宜、宿主细菌数量充足时,裂解性循环能使噬菌体快速扩增,占领生态位;当环境不利、宿主稀少时,溶原性循环允许噬菌体与宿主共生,通过细菌的繁殖被动传播,保证种群延续。前噬菌体在受到环境胁迫(如紫外线、化学诱变剂)时可以被激活转入裂解性循环,实现生活史的灵活转换。这种策略使噬菌体能够根据环境条件优化生存和繁殖策略,体现了病毒与宿主长期协同进化的结果,也反映了生命系统对环境变化的适应性。