生物工程理论与应用
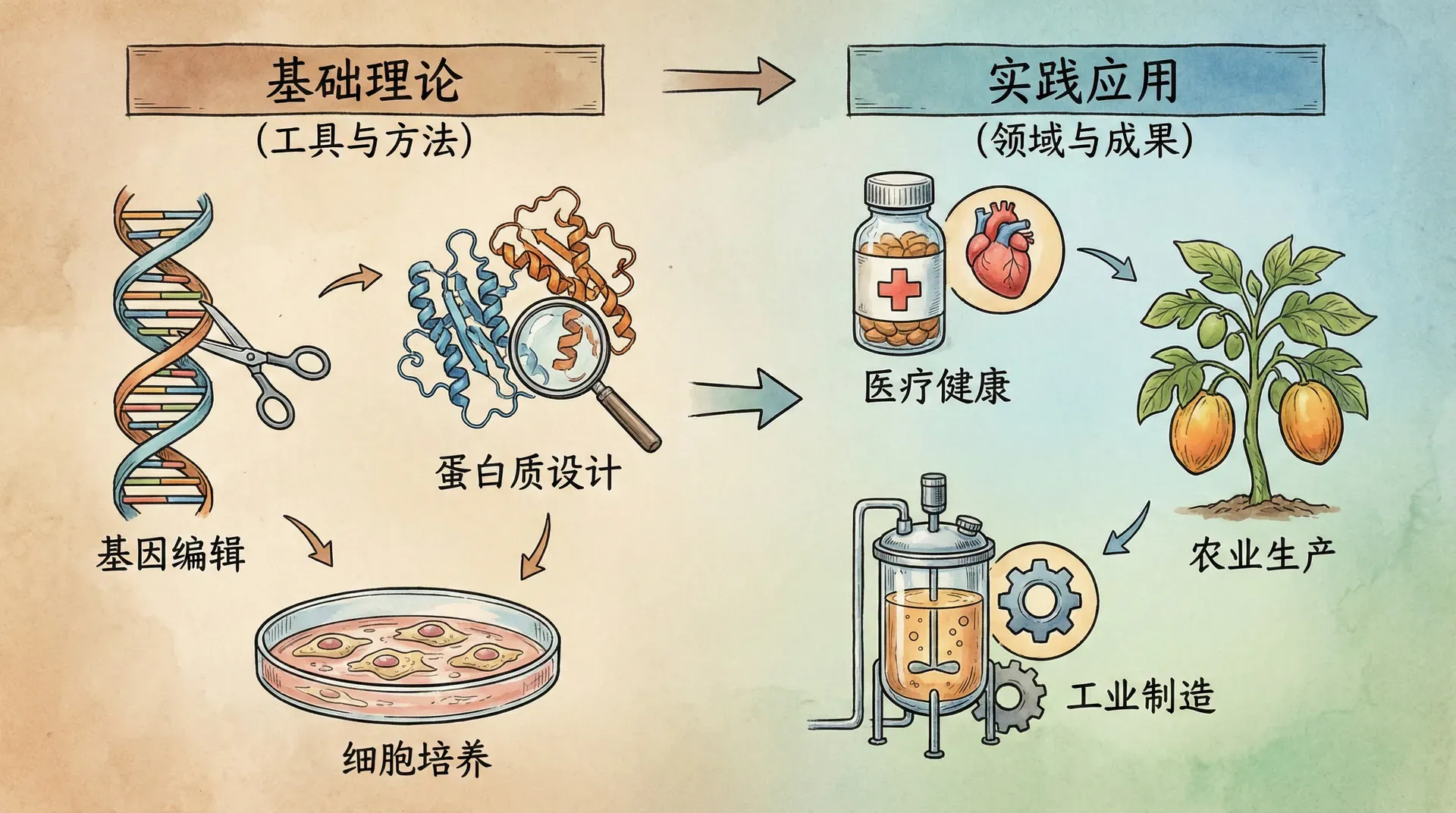
生物工程是一门以微生物、动植物细胞及其分子组成为操作对象,研究其生理、生化特性并加以人工调控,实现有用物质规模化生产的交叉学科。该领域融合了生物学、化学、物理学和工程学等多门科学原理,其核心在于利用现代生物技术提升工业生产效率、降低成本,并开发出更加安全环保的生产工艺。
在生物工程中,发酵工程、酶工程与细胞工程是最重要的分支。发酵工程主要研究微生物的大规模培养与目标产物的高效合成,广泛应用于医药、食品、环保和能源等领域。酶工程致力于酶的定向改造和高性能酶制剂的开发,实现绿色催化。细胞工程则通过基因编辑、细胞培养等手段生产疫苗、抗体和再生医学产品,是生物医药的核心技术。
随着基因工程和合成生物学的不断发展,生物工程正推动传统产业向智能化、绿色化和高值化转型。例如,CRISPR基因编辑工具的应用大幅提升了微生物菌种改良的效率和精度。合成生物学通过模块化设计,将人工合成的基因回路导入细胞工厂,能够定制生产高附加值化学品、药物和材料,这些创新极大地拓展了生物工程的应用边界。
此外,现代生物工程高度重视过程监控与全流程自动化管理。智能传感器、在线分析仪和人工智能算法的结合,实现了发酵、分离、纯化等关键环节的实时优化,显著提高了资源利用率和产品质量。这些前沿技术的应用,使得生物工程在推动可持续发展、应对全球资源和环境挑战中发挥着日益重要的作用。
固态发酵技术
固态发酵是一种在没有游离水存在的条件下进行的传统发酵工艺。这种技术在我国有着悠久的历史,从古代的酿酒、制酱到现代的生物技术产业,固态发酵一直发挥着重要作用。与液体发酵不同,固态发酵利用固体基质作为载体,微生物在相对较低的水分活度环境中生长繁殖并产生目标产物。
固态发酵技术的核心在于控制基质的水分活度,既要保证微生物正常生长,又要维持固态基质的结构稳定。
传统发酵工艺的应用
中国传统发酵工艺体现了固态发酵技术的精髓。以酱油生产为例,这一工艺完美诠释了固态发酵的基本原理和实际应用。
酱油的传统制作过程分为两个主要阶段。首先是制曲阶段,将大豆经过蒸煮后与小麦粉混合,接种米曲霉等微生物制成豆豉曲。在这个过程中,米曲霉的菌丝能够深入基质内部,分解蛋白质和淀粉,为后续发酵做好准备。
第二阶段是发酵阶段,将制好的豆豉曲与盐水混合进行长期发酵。在这个过程中,乳酸菌将糖类转化为乳酸,酵母菌产生乙醇和各种风味化合物,最终形成独特的酱油风味。
现代固态发酵技术的发展
现代固态发酵技术在传统工艺基础上实现了重大突破。以安琪酵母公司为例,该公司利用固态发酵技术生产酵母抽提物和各类酶制剂,年产值超过百亿元。通过精确控制发酵参数,现代工艺能够大幅提高产品质量和生产效率。
工艺参数控制与优化
固态发酵的成功关键在于精确控制各项工艺参数。水分活度是最重要的控制指标,通常需要维持在0.85-0.95之间。过高的水分会导致杂菌污染,过低则会抑制微生物生长。现代固态发酵车间通过自动化控制系统,实时监控温度、湿度、氧气浓度等关键参数,确保发酵过程的稳定性和可重现性。
温度控制同样至关重要。不同微生物对温度的要求不同,米曲霉的最适生长温度为30-35°C,而某些嗜热菌可以在50-60°C下正常生长。通过分阶段调控温度,可以实现不同微生物的有序生长和代谢产物的定向积累。
在固态发酵过程中,不同微生物的数量变化具有明显的阶段性特征。下图展示了米曲霉与乳酸菌在发酵120小时内的动态变化情况:
从图中可以看出,米曲霉在发酵初期快速生长,在48小时左右达到高峰,此后数量逐渐下降。乳酸菌则在中后期显著增殖,并在72小时达到最高值。两者的先后高峰反映了代谢底物和环境条件变化对微生物群落演替的影响。
质量控制与检测方法
现代固态发酵对产品质量提出了更高要求。传统的感官评价已经不能满足工业化生产的需要,必须建立科学的检测评价体系。
微量热法是目前应用较多的在线检测技术。通过监测发酵过程中的热量变化,可以实时了解微生物的代谢活动强度。当代谢活动旺盛时,产热量增加;当基质耗尽或出现抑制时,产热量下降。
近红外光谱技术也在固态发酵中得到广泛应用。该技术能够快速检测基质中的水分、蛋白质、糖类等成分含量,为工艺调控提供及时准确的数据支持。
华大基因等生物技术公司利用基因测序技术,建立了发酵微生物群落的分子指纹图谱,实现了对发酵过程微生物变化的精确监控。
微生物培养技术基础
培养环境的重要性
微生物培养是生物工程的核心环节。无论是实验室小试还是工业化生产,创造适宜的培养环境都是成功的关键。微生物对环境条件的要求非常苛刻,温度、pH值、氧气浓度、营养成分等因素都会直接影响其生长状况和产物合成。
在实验室阶段,我们通常使用摇瓶培养来筛选菌株和优化培养条件。标准的锥形瓶容量为250-500mL,装液量控制在总容量的20-30%,确保有足够的气液界面进行氧气传递。摇床的转速一般设置在120-180rpm,既能保证充分混合,又不会对微生物造成过度的机械损伤。
生物反应器的设计与应用
当实验室研究转向工业化生产时,生物反应器就成了不可或缺的核心设备。目前国内生物制药企业广泛使用的搅拌式反应器,容积从几十升到数百立方米不等。
华大智造等公司在生物反应器设计方面取得了重要进展。他们开发的智能化反应器系统能够自动调控溶氧、pH值、泡沫等关键参数,大大提高了生产稳定性和产品质量。
培养基优化策略
培养基是微生物生长的物质基础。工业生产中通常采用复合培养基,以玉米浆、豆粕粉等天然原料为主要成分。这些原料成本较低,但成分复杂,批次间差异较大,需要通过标准化处理来保证生产稳定性。
以青霉素生产为例,华北制药等企业通过几十年的工艺改进,建立了成熟的培养基配方体系。他们使用玉米淀粉作为主要碳源,花生饼粉提供氮源,并添加适量的磷酸盐、硫酸盐等无机盐类。
无菌操作技术
无菌技术是微生物培养成功的基本保障。在工业生产中,任何污染都可能导致巨大的经济损失。以新华制药的头孢菌素生产线为例,每批发酵液价值数百万元,一旦发生污染,不仅损失巨大,还会影响后续生产计划。
现代生物工厂采用多级过滤系统确保空气质量。进入发酵罐的空气必须经过初效过滤器、中效过滤器和HEPA高效过滤器三级过滤,将细菌和病毒的含量降低到安全水平。据统计,1立方米的自然空气中含有2000个左右的微生物,其中50%是真菌孢子,40%是革兰氏阴性细菌。
培养基的无菌处理通常采用高温高压灭菌。实验室规模使用高压灭菌器,在121°C下处理15分钟即可杀死包括芽孢在内的所有微生物。工业规模则采用连续灭菌工艺,培养基在140°C下保持2-3分钟,既保证灭菌效果,又最大限度地减少营养成分的破坏。
培养过程监控与调控
现代微生物培养过程实现了全程自动化监控。通过在线传感器实时监测溶氧、pH值、温度、泡沫高度等关键参数,并根据预设程序自动调节。
在微生物发酵过程中,通常需要实时监控关键参数如溶氧浓度(DO)、pH值和菌体浓度。下图展示了72小时典型发酵周期内这三个参数的变化趋势:
- 溶氧浓度:最初较高,随着菌体增殖和耗氧量上升而迅速下降,后期趋于稳定,但整体水平较低。溶氧是反映微生物代谢活力和通气搅拌状况的敏感指标。
- pH值:微生物代谢产酸或产碱会导致pH波动,早期逐步下降,指数生长期后适当回升,后期趋于平稳。pH的调控对于维持最优生长环境和代谢产物合成极为重要。
- 菌体浓度:经历缓慢增长(延滞期),随后快速上升(指数生长期),达到峰值后进入稳定期。菌体浓度直接反映了微生物生长状况。
通过自动化系统在线监测这些参数,并结合趋势分析,生产人员可以实时优化通气、加料、pH调节等操作,保障发酵过程高效稳定。
生长动力学与产物形成规律
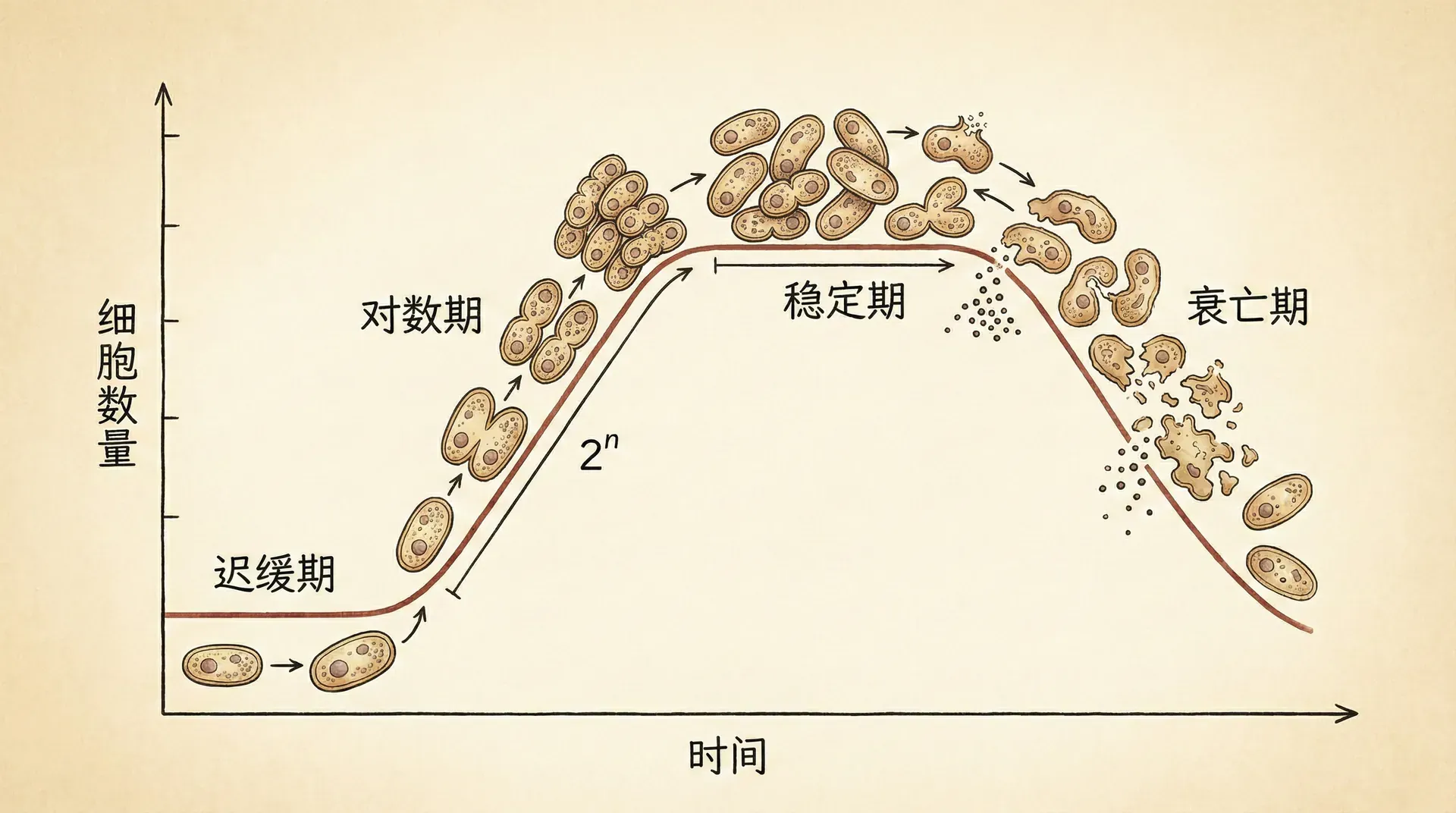
单细胞微生物的生长规律
理解微生物的生长规律对于优化培养工艺至关重要。单细胞微生物如大肠杆菌、酵母菌等通过细胞分裂进行繁殖,其生长过程遵循特定的动力学规律。
在适宜的培养条件下,微生物的生长可以分为四个明显的阶段。延滞期是微生物适应新环境的过程,此时细胞主要合成适应性酶类,为后续快速生长做准备。这个阶段的长短取决于接种物的生理状态和培养环境的差异程度。
指数生长期是微生物生长最活跃的阶段,细胞数量按指数规律增长。在这个阶段,微生物的比生长速率达到最大值,代谢活动最为旺盛。工业生产中通常选择在指数生长期末期进行诱导,以获得最高的产物产量。
微生物的比生长速率μ遵循Monod方程:μ = μmax × S/(Ks + S),其中S为限制性基质浓度,Ks为饱和常数。这个方程类似于酶动力学中的米氏方程。
产物形成的分类与特点
根据产物形成与细胞生长的关系,可以将微生物产物分为三大类。生长偶联型产物的形成与细胞生长同步进行,典型代表包括酵母菌体、乳酸、乙醇等。这类产物通常是微生物基本代谢的直接产物。
非生长偶联型产物主要在细胞生长减缓或停止后大量积累,如抗生素、维生素等次级代谢产物。这类产物的生产需要特殊的诱导条件,通常在营养限制或环境胁迫下产生。
基因工程菌的特殊性
基因工程菌的培养与天然菌株有所不同。以重组大肠杆菌生产人胰岛素为例,通博生物等公司采用分阶段培养策略。首先在不诱导的条件下培养工程菌至高密度,然后通过添加IPTG诱导目标蛋白表达。
这种策略的优势在于将菌体生长和产物合成分开进行,避免了外源蛋白对细胞生长的抑制作用。通过精确控制诱导时机和诱导剂浓度,可以使外源蛋白在总蛋白中的比例达到30-50%。
上图展示了重组大肠杆菌分阶段培养过程中菌体密度和目标蛋白在总蛋白中比例的变化。前12小时为菌体生长阶段,此时目标蛋白几乎不表达。12小时后加入IPTG诱导,目标蛋白比例迅速上升,最终在培养结束时达到45%。此策略有效提升了目标蛋白表达量,并减少对细胞生长的抑制。
连续培养与补料分批培养
为了提高生产效率,现代生物制造业广泛采用补料分批培养和连续培养技术。补料分批培养通过在培养过程中分批添加营养物质,延长生产周期,提高产物浓度。
华药集团在青霉素生产中应用补料分批培养技术,将发酵周期从3天延长到7天,产物浓度提高了2倍以上。关键在于精确控制葡萄糖的添加速度,既要保证微生物生长需要,又要避免分解代谢产物的积累。
补料分批培养的核心是防止基质抑制效应。过高的葡萄糖浓度会引起分解代谢阻遏,抑制抗生素等次级代谢产物的合成。连续培养技术在某些特殊产品生产中显示出独特优势。以重组酵母生产人胰岛素为例,诺和诺德等公司采用连续培养工艺,实现了稳定高效的产品输出。
发酵工程技术应用
传质与混合技术
发酵工程的核心挑战之一是如何实现高效的传质和混合。在大型生物反应器中,营养物质和氧气的传递效率直接影响微生物的生长状况和产物质量。
以中粮生化的赖氨酸生产线为例,其主发酵罐容积达到500立方米,内部安装多层搅拌桨确保充分混合。通过CFD流体力学仿真优化搅拌器布局,将混合时间从原来的8分钟缩短到3分钟,显著提高了生产效率。
氧气传递是好氧发酵的限制性因素。现代发酵工艺采用多种方法提高氧传递效率,包括增加搅拌强度、优化曝气系统、使用富氧空气等。体积传氧系数KLa是评价传氧效率的重要指标,实验室反应器可达到800-1200 h⁻¹,而工业反应器一般为500-800 h⁻¹。
温度控制系统
发酵过程中的温度控制对产品质量至关重要。微生物代谢和搅拌作业会产生大量热量,必须通过冷却系统及时移除。不同阶段对温度的要求也不相同,需要精确的调控策略。
东北制药在青霉素生产中采用分段温控策略。发酵前期维持30°C促进菌体生长,中期提高到32°C加速代谢,后期降至28°C稳定产物结构。这种精细化控制使青霉素产量提高了15%。
泡沫控制技术
发酵过程中产生的泡沫会干扰传质效果,降低有效容积,严重时甚至导致培养液外溢。传统的机械消泡器已逐渐被化学消泡剂取代,但化学消泡剂可能影响产品纯度。
新华制药开发了物理-化学联合消泡技术,通过超声波破碎泡沫结构,同时添加少量食用级硅酮消泡剂。这种方法既保证了消泡效果,又满足了药品生产的安全要求。
在线监测与过程控制
现代发酵工艺实现了关键参数的实时监测和自动控制。除了传统的温度、pH、溶氧等参数外,还引入了更多先进的分析技术。
科伦药业在头孢菌素生产中应用近红外光谱技术,实现了菌体浓度和产物浓度的实时监测。通过建立化学计量学模型,预测精度达到95%以上,为工艺优化提供了可靠数据支持。
放大效应与工艺优化
从实验室小试到工业化生产,反应器容积增加了数千倍甚至上万倍,这必然带来传质、传热等方面的挑战。传统的按比例放大方法往往不能获得理想效果,需要深入研究放大规律。
工业反应器的混合时间通常比实验室反应器长几十倍,这会导致局部营养浓度不均,影响产物质量的一致性。
齐鲁制药在放大过程中遇到产量下降的问题。通过分析发现,大型反应器的剪切力分布不均匀,对菌丝体造成不同程度的损伤。他们采用多层搅拌桨设计,优化了剪切场分布,成功解决了放大难题。
现代发酵工艺优化越来越依赖于数学模型和计算机仿真。通过建立包含传质、传热、生化反应的多尺度模型,可以预测不同操作条件下的发酵效果,指导工艺改进。
图表显示了不同反应器直径下传统放大和优化放大两种方法对相对产量的影响。可以看出,随着反应器直径的增大,传统放大方法的相对产量急剧下降,而优化放大方法能够有效减缓产量下降趋势,在大体积反应器中仍能保持较高的产量。这说明通过优化工艺参数和放大策略,可以显著提高工业规模发酵的产物得率。
产品分离与纯化技术
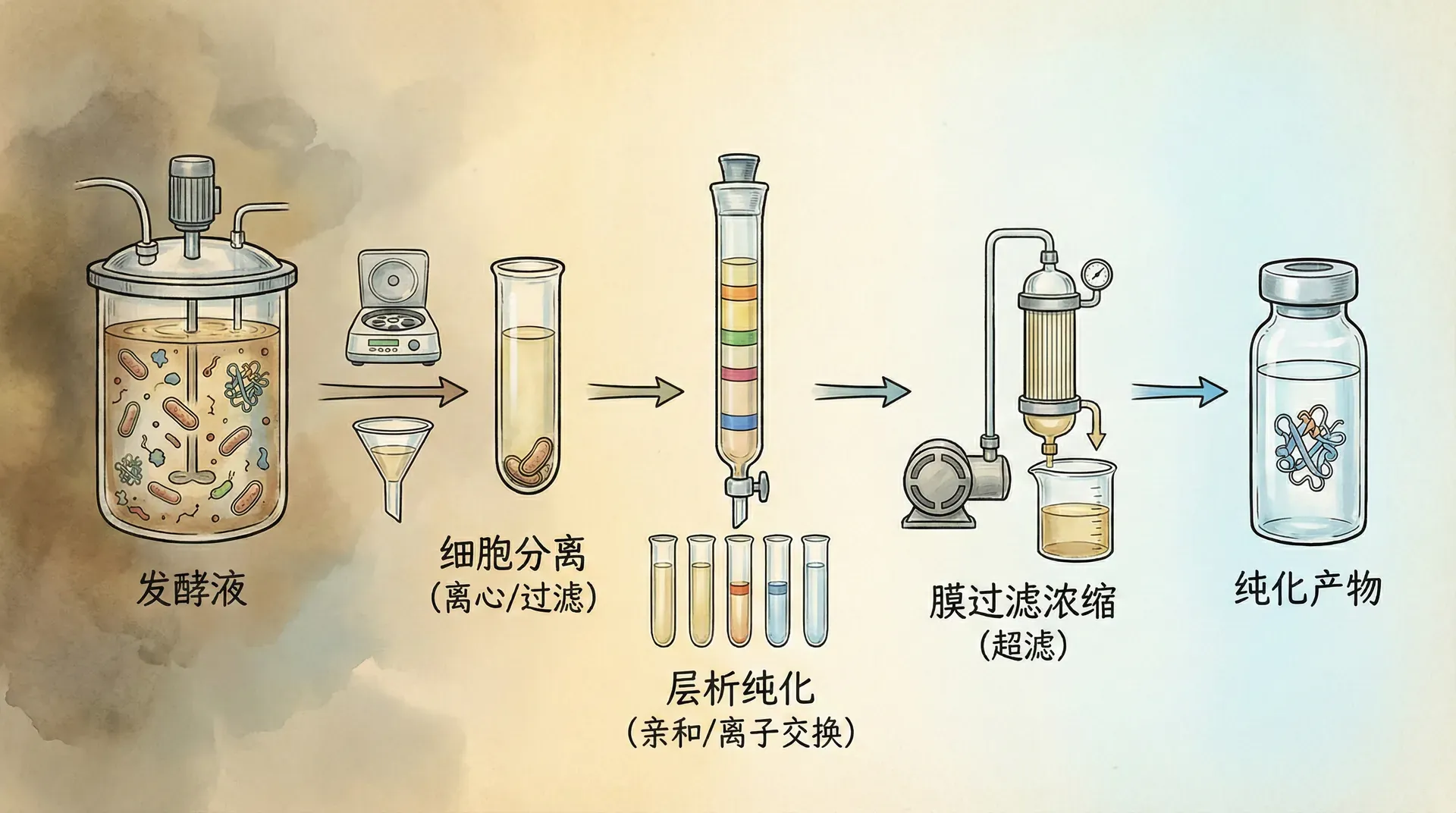
细胞分离技术
发酵结束后首先要进行的是细胞与培养液的分离。这个看似简单的过程实际上对后续纯化效果有重要影响。传统的离心分离法适用于大多数细菌和酵母,但对于丝状真菌则效果较差。
华药集团在青霉素生产中采用旋转真空过滤机进行细胞分离,处理能力达到每小时50立方米。通过预涂硅藻土助滤剂,不仅提高了过滤速度,还显著改善了滤液的澄清度。
对于胞内产物的提取,需要先进行细胞破碎。高压均质是最常用的方法,通过高压使细胞通过狭小缝隙时受到强烈剪切力而破碎。新型的微射流均质机工作压力可达1500bar,破碎效率比传统方法提高30%以上。细胞破碎程度需要精确控制。破碎不充分会降低产物回收率,过度破碎则会释放更多杂蛋白和核酸,增加后续纯化难度。
蛋白质纯化工艺
蛋白质类生物制品的纯化是整个生产过程中技术含量最高、成本占比最大的环节。以重组人生长激素为例,从发酵液到成品的纯化成本占总生产成本的60%以上。
现代蛋白质纯化通常采用多步色谱法。首先使用离子交换色谱进行粗分离,去除大部分杂蛋白;然后用疏水相互作用色谱进一步纯化;最后通过凝胶过滤色谱进行精制,同时实现脱盐和浓缩。
亲和色谱技术
亲和色谱是最高效的蛋白质纯化技术,能够实现一步法高度纯化。以单克隆抗体生产为例,Protein A亲和色谱可以将抗体纯度从50%直接提升到95%以上。
上海君实生物在PD-1抗体生产中应用改进的Protein A填料,将结合容量从20mg/mL提高到40mg/mL,大大降低了纯化成本。同时通过优化洗脱条件,减少了抗体的聚集和降解。
组氨酸标签纯化是重组蛋白纯化的常用技术。通过在目标蛋白N端或C端融合6个组氨酸残基,可以利用金属螯合亲和色谱进行快速纯化。这种方法特别适用于大肠杆菌表达的重组蛋白。
此图展示了目标蛋白和杂蛋白在亲和色谱过程中的洗脱曲线。横轴为洗脱体积,纵轴为蛋白浓度。可以看到,杂蛋白主要在早期被洗脱掉,随着洗脱体积增加,目标蛋白在50 mL处达到峰值,浓度最高,说明此时目标蛋白纯化效果最佳。从曲线可以直观判断分离纯化的效果及最佳收集分段,有助于优化纯化工艺参数。
膜分离技术
膜分离技术在生物制品生产中发挥着越来越重要的作用。超滤技术既可以用于蛋白质浓缩,也可以实现不同分子量蛋白的分离。微滤膜则主要用于除菌和澄清。
海正药业在干扰素生产中采用切向流超滤技术,将产品浓度从1mg/mL提高到20mg/mL,同时去除了95%以上的小分子杂质。通过优化膜材料和操作条件,蛋白回收率保持在98%以上。
病毒安全是生物制品必须考虑的问题。纳滤技术能够有效去除潜在的病毒污染,成为血液制品和疫苗生产的关键工艺。20nm孔径的纳滤膜可以截留包括细小病毒在内的所有已知病毒。
膜分离过程中的蛋白吸附和浓缩极化现象会导致通量下降和产品损失,需要通过优化操作条件和膜材料来减少这些不利影响。
结晶与干燥技术
对于小分子产品,结晶是最终纯化的重要手段。以维生素C生产为例,东北制药通过控制结晶条件,获得了纯度99.5%以上的产品。结晶过程中的温度、pH值、搅拌速度等参数都会影响晶体的形态和纯度。
冷冻干燥是生物制品保存的首选方法。通过在低温低压条件下升华除水,既保持了产品的生物活性,又便于长期保存。华兰生物在血浆制品生产中应用先进的冷冻干燥技术,产品稳定性大大提高。
喷雾干燥适用于热稳定性较好的产品。安琪酵母在酵母抽提物生产中应用喷雾干燥技术,不仅提高了生产效率,还改善了产品的溶解性和流动性。
生物工程经济分析
成本结构分析
生物制造业的成本构成与传统化工行业有显著差异。人工成本占比较高,通常达到总成本的20-30%。这主要因为生物生产过程需要高技能操作人员,且对无菌操作要求极严格。
以华药集团的青霉素生产线为例,其成本构成呈现明显特点。原材料成本占45%,其中玉米淀粉等碳源占30%,花生饼粉等氮源占15%。能耗成本占20%,主要用于灭菌、冷却和搅拌。人工成本占25%,设备折旧占10%。
设备投资与回收期
生物制造项目的设备投资巨大,一条年产千吨级抗生素生产线的设备投资通常超过5亿元。设备的技术先进性直接影响产品质量和生产效率。
投资回收期是评价项目经济性的重要指标。一般而言,生物制药项目的投资回收期为6-8年,生物化工项目为4-6年。新华制药在头孢菌素项目上的投资回收期为5.5年,主要得益于其先进的工艺技术和规模效应。
规模效应分析
生物制造业存在明显的规模效应。随着生产规模扩大,单位产品的固定成本分摊减少,边际成本递减。但这种效应并非无限制的,当规模超过某个临界点后,管理复杂性增加可能抵消规模优势。
阜丰集团在味精生产中充分体现了规模效应。其单厂年产能达到80万吨,单位产品成本比中等规模企业低25%左右。关键在于其采用了大型发酵罐(500立方米以上)和连续化生产工艺。
在下图中,显示随着产量增加,市场利润率下降;绿色曲线代表“生产成本优势”,表现为规模扩大带来成本下降,利润率提升。两条曲线的交点附近,即“最优规模”(图中已标注),表示在此规模下,既能保证较高的市场需求利润率,又能充分发挥生产规模带来的成本优势,从而实现企业利润最大化。
技术创新的经济价值
技术创新是生物制造企业保持竞争优势的根本途径。以安琪酵母为例,其通过自主研发的酵母细胞自溶技术,将酵母抽提物的生产成本降低了30%,同时产品质量显著提升。
工艺优化带来的经济效益往往超出预期。华药集团通过改进青霉素发酵工艺,将产量从每升6万单位提高到15万单位,直接节约生产成本40%以上。据统计,生物制造企业研发投入占销售收入的比例平均为8-12%,远高于传统制造业的2-4%。但这种投入能够带来持续的竞争优势和超额利润。
市场前景与发展趋势
中国生物制造业正迎来快速发展期。根据工信部数据,2023年生物制造业总产值超过4万亿元,预计到2030年将达到8万亿元。其中,生物医药、生物化工、生物材料是增长最快的三个领域。
细分市场中,疫苗、单克隆抗体、基因治疗等高技术含量产品增速最快。以COVID-19疫苗为例,国药集团、科兴生物等企业在疫情期间实现了跨越式发展,产能和技术水平均达到国际先进水平。
随着人口老龄化和健康意识提升,生物医药市场需求持续增长。预计未来10年,中国生物医药市场将保持年均15%以上的增长率。
产业集群化发展趋势明显。长三角、珠三角、环渤海等地区形成了各具特色的生物产业集群。以苏州生物医药产业园为例,聚集了信达生物、基石药业等知名企业,形成了完整的产业链条。技术发展方向上,合成生物学、细胞培养肉、生物基材料等新兴领域备受关注。这些技术有望在未来5-10年内实现产业化,为整个行业带来新的增长动力。