基因组变异
每个人都拥有独特的基因组特征,就像指纹一样,世界上没有两个完全相同的基因组。这些基因序列的细微差异塑造了我们与生俱来的体质、外貌特征,也决定了我们是否容易患某些疾病,对特定药物的反应强弱,甚至具有某些遗传性疾病的风险。基因组的多样性不仅为人类演化提供了可能,同时也影响着我们对环境刺激和疾病的免疫能力。随着中国基因检测技术的快速发展,我们正在进入一个能够通过基因信息指导医疗决策的新时代。基因检测正逐渐走进寻常百姓家,从个体健康评估、遗传病筛查,到精准用药和疾病风险预测,越来越多的人开始关注自身的遗传信息。
基因组变异,是指不同个体间DNA序列的差异。这些差异虽然在30亿个碱基对中只占少数,却可能对健康产生重大影响。正是这些微小的变异造就了人类的多样性。
2003年,人类基因组计划的完成,标志着基因学研究迈入了全新的时代。此后,现代测序技术(如高通量测序、二代测序)迅猛发展,不仅大幅降低了基因检测的成本,还显著缩短了检测周期,使个体化医疗成为可能。在中国,从华大基因、贝瑞基因、金域医学等企业,到各大科研院所和医院,基因检测行业经历了爆发式增长,推动了从人类遗传组学研究到产业应用的转型。同时,基因科普知识不断普及,公众对基因健康管理的认知逐步提升。
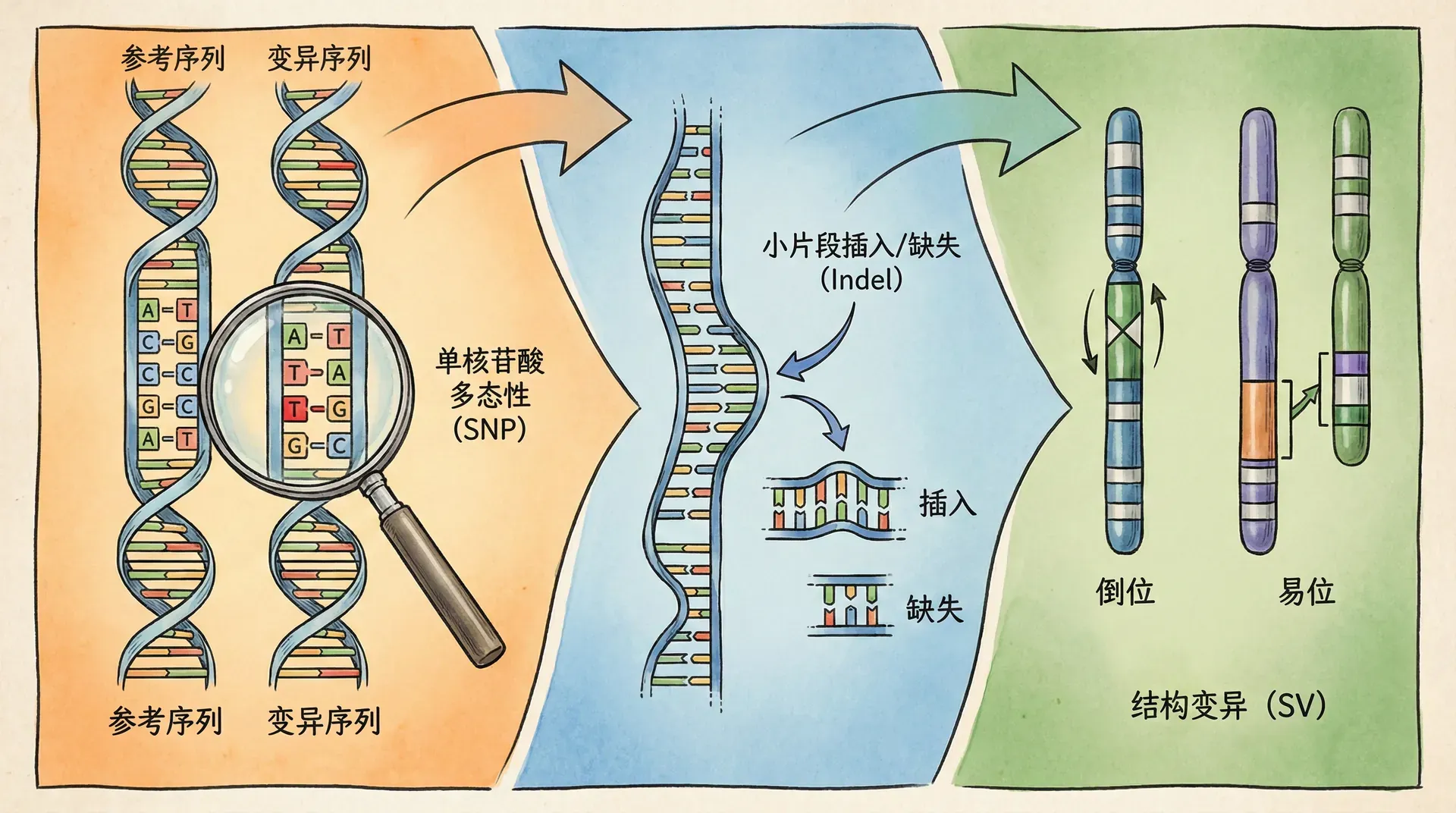
人类基因组中的变异类型
单核苷酸多态性
单核苷酸多态性(Single Nucleotide Polymorphisms,SNPs)是人类基因组中最常见、最基本的变异形式。假如把整个人类基因组比作一本有30亿个字母的书,SNPs就是某些具体位置上“字母”的单个差异。据估计,人类基因组中共存在一千多万个SNPs位点。大多数SNPs对个体影响有限,但有些SNPs却可能影响蛋白的结构和功能,从而与疾病风险、药物反应紧密相关。
在中国人群中,由于地域辽阔、民族多样,SNPs的分布呈现独特特征。例如,北方汉族与南方汉族在部分SNP位点频率上存在显著差异,反映出历史迁徙与自然选择的痕迹。55个少数民族及其特有SNPs则极大丰富了中国基因多样性,为疾病及适应性研究提供了重要资源。
拷贝数变异
除了单个碱基的变化之外,还存在一类反映较大结构变异的基因组变异——拷贝数变异(Copy Number Variations,CNVs)。CNVs指的是基因组中某些大片段(通常大于1000个碱基对)的插入、缺失或重复。这类变异可能覆盖编码基因或调控区域,对基因剂量和功能产生显著影响,在发育障碍、肿瘤等疾病发生中扮演关键角色。
拷贝数变异就像书中某些段落的重复、缺失或重写,虽然不必然影响整个故事梗概,但有时会改变剧情发展或角色表现,类似地,CNVs可能增强、减弱或消除相关基因的表达。
中国基因变异数据库建设
为系统收集和整理中国人群特有的基因变异信息,提升疾病预防、诊断和治疗精度,中国近年来启动了若干具有里程碑意义的项目与数据库建设:
这些项目汇聚了覆盖全国各主要民族、地区的人群样本,通过高通量测序与大数据整合,构建了丰富的变异信息库。研究人员据此发现了许多中国人群特有或高频的遗传变异,识别出某些疾病的易感基因或保护型变异,极大推进了精准医疗、基因药物开发和健康管理的进步。此外,大型数据库为开展GWAS等群体研究提供了宝贵的数据基础,也推动了遗传咨询、罕见病诊断等多领域应用。
基因变异的功能影响
基因变异对个体的生理与健康会产生多层面的影响。按照其功能可大致分为:
在中国人群中,一些特定的功能性基因变异频率显著高于其他人群。例如,影响酒精代谢的ALDH2基因变异在东亚人群(包括中国)中极为常见,这种变异导致酗酒时脸部潮红、心跳加速,是对酒精分解能力的直接体现。此外,G6PD缺乏症、地中海贫血等遗传性疾病相关变异,在南方及部分少数民族群体中也有较高分布,反映了遗传变异与自然选择、地理分布之间的复杂关系。
需要注意的是,基因变异的影响并非绝对,环境因素如饮食结构、生活方式、感染与暴露等同样起着决定作用。相同的基因变异在不同环境下可能导致完全不同的表型效应,这也是为何遗传咨询需结合个人、家庭和环境多维信息。
随着测序技术的不断进步和成本的持续下降,基因检测正从科研工具逐步转变为常规临床应用的重要手段。在中国,越来越多的医院和体检机构开始将基因检测纳入日常健康管理。未来,基因大数据与人工智能相结合,有望实现更加个性化的疾病风险预测、诊疗方案优化和用药方案制定,为大众健康创造更大价值。
基因变异与疾病易感性
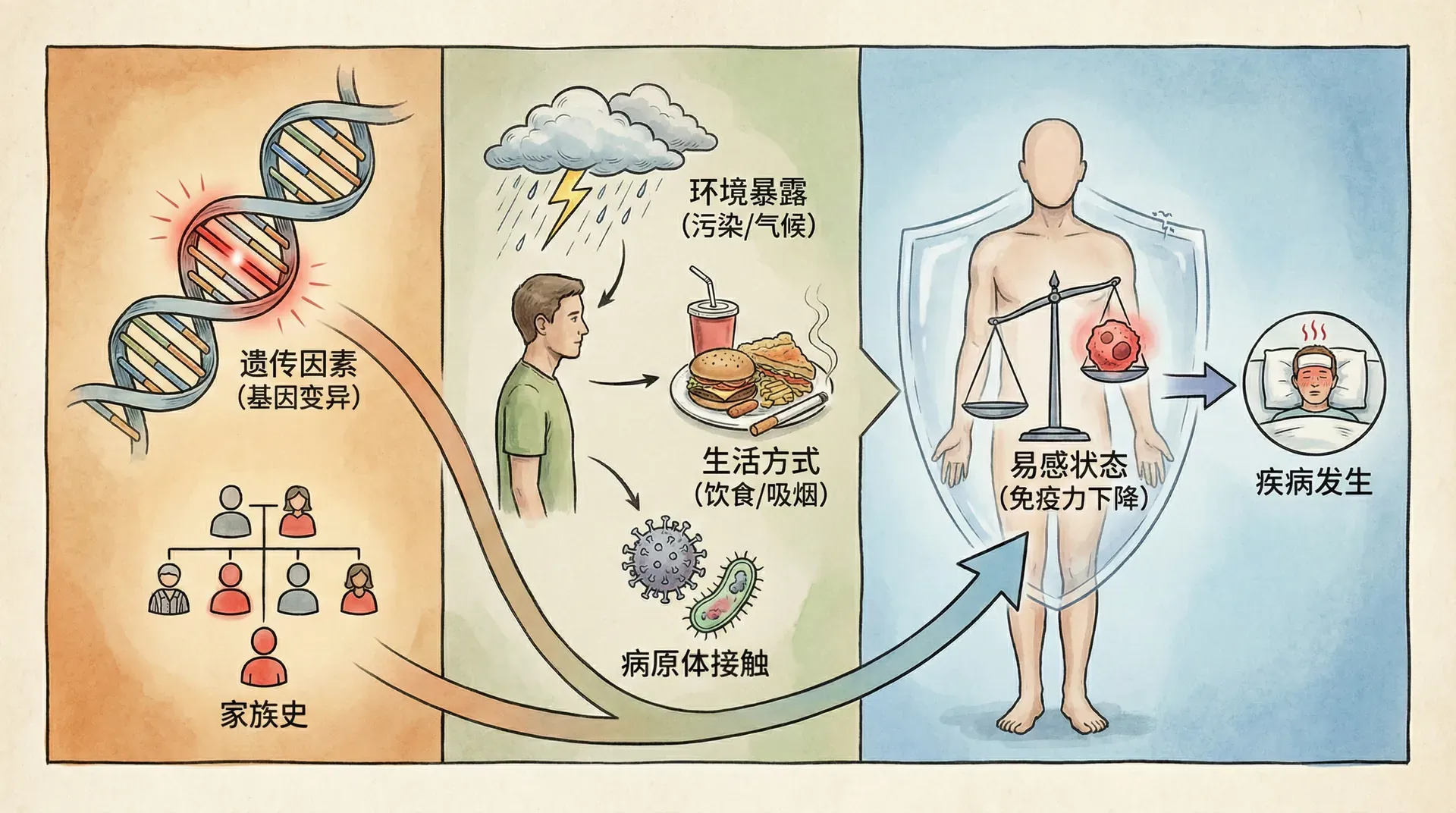
基因变异对疾病的影响犹如一把“双刃剑”,既可能增加某些疾病的风险,也可能赋予持有者一定的保护作用。例如,有些遗传变异会导致疾病易感性上升,而另一些则提高个体对环境与疾病的适应能力。中国庞大的人口、广阔的地理跨度和丰富的民族结构促使不同地区和族群之间的基因变异及其疾病谱独具特色。这种差异不仅影响疾病的发生机制,也为人群健康评估和精准医疗奠定了基础。
中国常见遗传性疾病
在中国人群中,遗传性疾病呈现出鲜明的地域和民族差异。例如,地中海贫血在广东、广西、海南等南方地区和部分少数民族中高发,而苯丙酮尿症则多见于北方省份。此外,G6PD缺乏症在两广、新疆、云南的部分人群中有较高发病率。这些分布特点常与特定基因突变频率及历史人口迁徙密切相关。
常见遗传性疾病及其流行区域一览:
随着基因检测技术和分子诊断在医院及基层医疗的普及,越来越多省份已建立遗传病基因信息库,推动出生缺陷防控和早期筛查。例如,广东省、上海市等地均已将新生儿遗传代谢病筛查纳入常规公共卫生项目,显著提高了遗传病干预水平。
基因组关联研究(GWAS)在中国的发展与突破
全基因组关联研究(GWAS)是寻找复杂疾病相关遗传变异的国际前沿方法。近年来,依托中国大规模生物样本队列和多民族协作网络,国内学者在GWAS领域连续取得重要成果。
部分近年中国人群GWAS重大成果示例:
GWAS不仅助力发现了糖尿病、冠心病、肿瘤等高发病的易感基因,还系统揭示了某些中国特有SNP位点,为后续药物研发和风险分层管理提供了新途径。
科学家还发现,部分疾病相关变异呈现明显的族群特异性分布,这意味着“欧美数据为主”的疾病风险模型并不完全适用于中国人群,亟需本土化的遗传学研究和大队列随访。
实际应用:
- 近年来某高校团队在广西侗族和云南彝族等少数民族队列中通过GWAS方法,发现与高原心脏耐受相关的新型变异,有望指导高原疾病防控和个体健康评估。
- 针对2型糖尿病,研究者整合遗传、生活方式、环境暴露等多维数据,设计出中国人群专属的疾病风险预测工具,提高了早筛准确率。
结构变异与疾病关联
除了常见的SNP变异,拷贝数变异(CNVs)、大片段插入/缺失和染色体重排等结构性变异正日益被重视。这类变异可能影响多个基因及其上下游调控网络,导致功能丧失、表达异常甚至融合基因产生,进而触发疾病。例如,在中国某些遗传性贫血、智力发育障碍以及部分肿瘤中,都观察到特定的结构变异特征。
中国人群中某些结构变异与疾病的关联度甚至高于欧美人群。这一现象表明遗传变异与本地环境、饮食文化、生活习惯等因素高度互动,推动中国本土人群特异性遗传研究及创新型风险预测模型建设更为迫切。
例如,慢性乙型肝炎的某些HLA区段的CNV变化影响病毒清除率和慢性化趋势,尤其在南方及西南地区高发族群中意义重大。此外,中国医学科学院等单位曾发现,部分源自欧美的重点变异在中国人群呈现不同的分布频率和生物学效应,这再次强调了本土详尽研究的重要性。
转录组分析与基因表达调控
基因变异为疾病提供了遗传基础,但其最终是否导致疾病很大程度上取决于对基因表达的影响。基于转录组(RNA测序)的研究,科学家系统揭示了遗传变异如何调控基因表达、信号通路激活及下游表型改变。
最新前沿进展包括:
举例说明:
- 某项关于糖尿病的转录组研究指出,江苏沿海地区患者中,IRS1基因调控区域的特定变异会下调胰岛素信号传导相关通路,直接影响血糖水平和并发症发生率。
- 通过横断多组学整合,中国学者已能描绘从基因变异到基因表达再到临床表型完整的“疾病发生路径图”,为精准健康管理、疾病干预疗法提供理论依据和实践指导。
总体来看,未来中国基因变异及其功能研究,将从单基因、单病种拓展到系统网络和时空维度,并伴随大规模组学数据积累持续推进,为中国人群的疾病预防、预测和个体化医学带来更多可能。
个性化医疗与药物基因组学
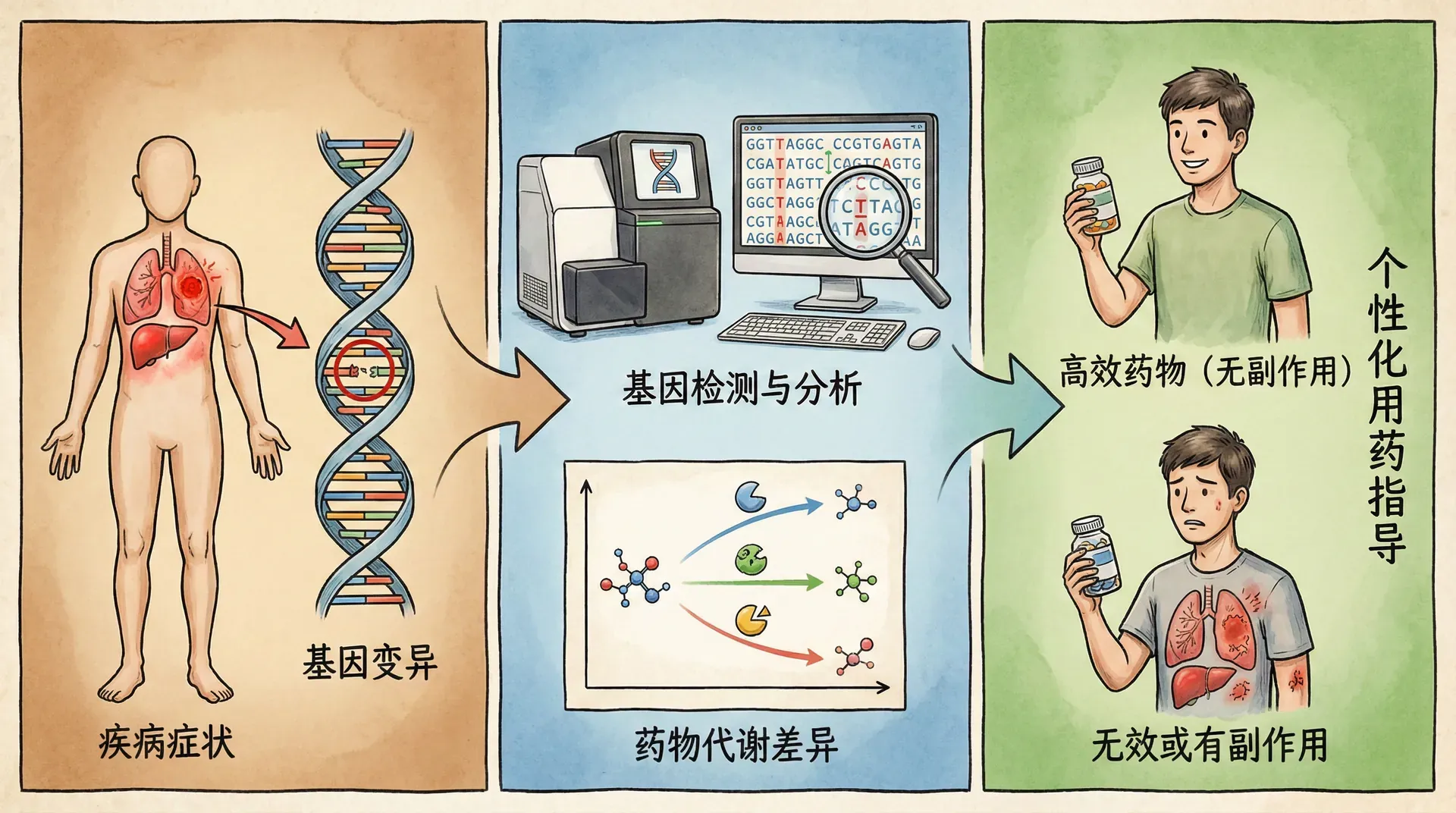
个性化医疗(Precision Medicine)是以患者特征为核心,融合遗传、环境、生活方式等多维信息,最终实现“因人施治”的新型医学模式。与传统的“疾病-药物-患者”一刀切管理相比,个性化医疗能够显著提升治疗效果,减少副作用,尤其在遗传多样性丰富的人群中意义重大。
近年来,随着全基因组测序、芯片检测、PCR等分子技术的普及和降价,越来越多的中国医院、药企和科研机构将基因信息纳入诊疗体系。例如,部分大型三甲医院建立了专门的遗传咨询和精准用药门诊,部分城市甚至试点了“基因健康档案”项目,为居民提供个性化的健康管理和疾病预警。
药物不良反应的基因基础
药物不良反应(Adverse Drug Reaction, ADR)长期以来是制约药物安全应用的重要因素。据估计,在中国,每年因药物不良反应导致的住院患者约占总住院人数的2-3%,而病情加重、住院时间延长、甚至死亡的案例也时有发生。受种系变异、代谢能力差异等影响,部分常用药物对不同个体产生完全不同的疗效和毒性反应。
目前已知,临床常见药物如华法林、抗抑郁药、β受体阻滞剂、降压药等多个药物的产生ADR的风险均与基因型密切相关。
中国人群中常见的CYP2D6基因多态性会显著影响数十种药物的代谢,包括抗抑郁药、抗心律失常药、止痛药等。不同等位基因型的患者,药物血药浓度差异可达数倍,直接影响疗效和副作用。
此外,如NAT2、TPMT、CYP2C19等基因的变异也影响异烟肼、硫唑嘌呤、氯吡格雷等多种药物的个体反应,已经写入部分国外用药指南。中国人群的特有高频等位变异,使得本土药物基因组学研究和给药标准的制定更加迫切。
中国药物基因组学发展现状
中国在药物基因组学领域虽起步较晚,但进展迅猛。自2010年以来,国家药监局(NMPA)率先要求部分药物说明书中列明相关遗传检测建议,推动了药物伴随诊断(CDx)的产业化发展。同时,国家精准医疗计划和多中心大队列项目为药物基因组学研究提供了丰富的临床和样本资源。
越来越多中国药品说明书推荐开展基因检测,如华法林、卡马西平、氯吡格雷等。临床指南逐步细化到“根据患者基因型调整处方剂量或选择替代药物”,极大提升了个性化用药安全性。
除了临床应用层面,近年中国药物基因组学论文、专利和技术储备取得快速增长,多个遗传检测试剂盒获得国内外认证,形成了集科研、检测、临床为一体的完整创新链条。
中国个性化医疗的产业发展
主要企业和技术平台
个性化医疗产业链覆盖了上游仪器试剂研发制造、中游检测/测序服务、下游数据分析和临床健康管理,已形成多元化和国际接轨的生态体系。除了知名第三方检测机构、学术医院平台,不少AI医疗初创公司、互联网基因健康企业也积极布局,为个体、医院和药企提供全流程解决方案。
此外,金域医学、泛生子、启函生物、华银健康等公司也在生育筛查、肿瘤诊断、干细胞等细分赛道进入头部阵营。国产高通量基因测序仪、AI辅助诊断平台、基因大数据云平台等逐步实现国产替代,为行业健康可持续发展打下基础。
临床应用的挑战与机遇
虽然中国个性化医疗发展速度快、产业生态逐渐成熟,但在普及推广过程中依然面临诸多挑战和瓶颈。
- 医疗一线医生对基因检测结果的解读、转化尚需进一步培训和规范;
- 现有基因检测临床指南、医保报销政策、伦理审批等配套体系不够完善;
- 大部分基因检测仍集中在大城市和高端医院,基层和中小城市普及度较低;
- 患者基因隐私保护、数据安全等新型法律伦理问题亟待规范。
目前中国只有约30%的临床医生接受过药物基因组学相关培训,这在很大程度上限制了基因检测及个性化医疗服务的广泛应用。加强医护人员培训和大众科普是未来的重要方向。
另一方面,庞大的人口基数、丰富的民族多样性和大样本遗传数据库建设为中国个性化医疗提供了巨大发展潜能。随着AI与生物信息技术的深度融合、医保政策和分级诊疗体系的完善、群众健康意识的提升,中国有望在全球精准医疗领域占据越来越重要的位置,推动本土创新和健康管理的深度变革。
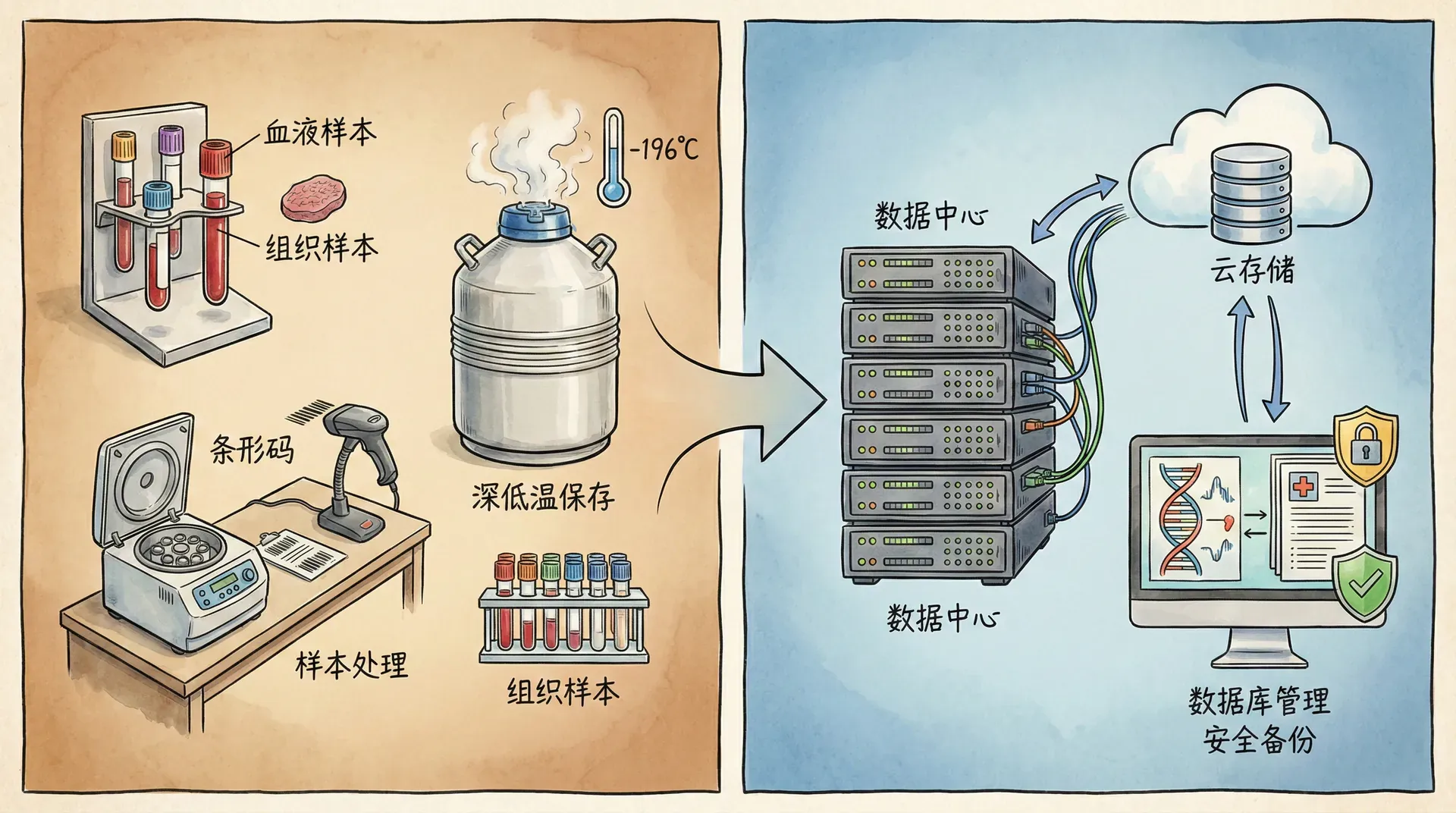
数据存储与生物样本库建设
随着测序技术的飞速发展,基因组数据正在以爆炸式的速度增长。根据最新统计,从2015年到2023年,中国产生的基因组数据总量实现了指数级攀升。如今,单个人类全基因组的数据量大约在80-200GB,而针对更高深度、高覆盖度的研究,这一数据还将持续扩大。到2025年,仅中国范围内的基因组数据年产量有望突破9500PB,远远超过早年生物信息学基础设施的承载能力。
此外,除人类基因组外,临床诊断、肿瘤组学、单细胞组学、微生物组、动植物遗传资源等多领域的测序项目同步推进,数据类型进一步丰富,跨学科协同需求愈发强烈。数据的存储、调阅、分析与再利用面临前所未有的技术和管理挑战。
数据存储的技术挑战
基因组数据的突出特性是体积庞大、增长迅猛且实时性要求高,迭代更新快。传统的本地服务器、冷存储、磁带归档等方式,已难以应对日益增长的数据压力。此外,原始测序数据(如FASTQ)、处理数据(如BAM、VCF)、注释数据、分析结果等多种数据形态互相依赖,格式繁杂,管理难度显著提升。
因此,云计算、分布式存储与高性能并行计算架构成为主流选择。中国的阿里云、腾讯云、华为云等头部平台不仅提供大容量云存储,还集成弹性资源、可扩展的生物信息分析工具,以及可追溯的数据安全体系,极大推动了科研和产业的发展。例如,部分平台已可实现1000+样本的测序分析一站式交付,显著缩短了研究周期。
中国的云服务平台如阿里云、腾讯云、华为云,均设有专门的基因组分析服务:支持原始数据上传、自动化质控、可视化结果展示及生信流程自动编排,为医院、药企和科研机构解决数据存储与计算难题,同时确保敏感数据的本地化合规存管。
中国生物样本库建设现状
近年来,随着精准医疗和分子诊断的应用需求激增,中国生物样本库的建设步伐显著加快,平台数量、管理规范和资源规模均处于国际领先水平。样本库不仅成为基础与临床研究的重要依托,还在新药研发、疾病预警及公共卫生领域发挥了关键作用。
国家级与区域性生物样本库
在国家政策与重大科研项目推动下,国内已建成遍布东西南北中的多层级、各具特色的样本库网络。其中,若干国家级样本库拥有百万至数百万份样本的储存能力,并覆盖多民族、多疾病种类,实现了大样本规模和多样性协同发展。例如:
这些样本库不仅存储血液、尿液、组织、DNA、RNA等多类型生物标本,还采集了丰富的表型、医疗记录、环境和生活方式数据,实现了"样本+全景数据"的高集成管理。在支撑基础研究的同时,也为药企、诊断企业和政府部门构建健康大数据资源池。
案例对比
- 国家基因库:聚焦多组学数据整合,面向全国科研、医疗和产业界开放共享,每年支持数千项研究与产学研合作。
- 协和医院生物样本库:深度覆盖肿瘤、心血管等高发疾病,建立标准化临床随访体系,提升样本与临床数据耦合度。
样本质量控制与标准化流程
高质量生物样本和规范信息化管理体系,是确保科研和临床结果可靠再现的前提。中国样本库逐步对接国际权威指南,如ISBER、ISO20387,同时在本土创新实践中不断优化全流程:
- 采集环节:统一使用预处理试管,常温或4°C送检,2小时内完成初步处理。
- 处理与存储:生物样本分层离心、分装,采用-80°C、液氮等低温长期保存。关键节点自动扫码管理。
- 全程信息化追踪:引入条形码/二维码溯源,每一份样本拥有唯一身份标识,采集-运输-入库-出库全记录,极大降低人为误差。
标准化的样本采集和管理流程,是中国大规模队列研究、“千人千面”精准医疗实现的质量保障。依托科技手段,目前部分头部样本库已实现自动化处置、远程监控和出入库智能化管理,进一步提高效率和安全性。
此外,针对样本出借、诊疗研究及对外合作,样本库普遍建立了严格的伦理审批和利益冲突管理流程,避免资源滥用,推动生物资源合规流转。
数据共享与隐私保护
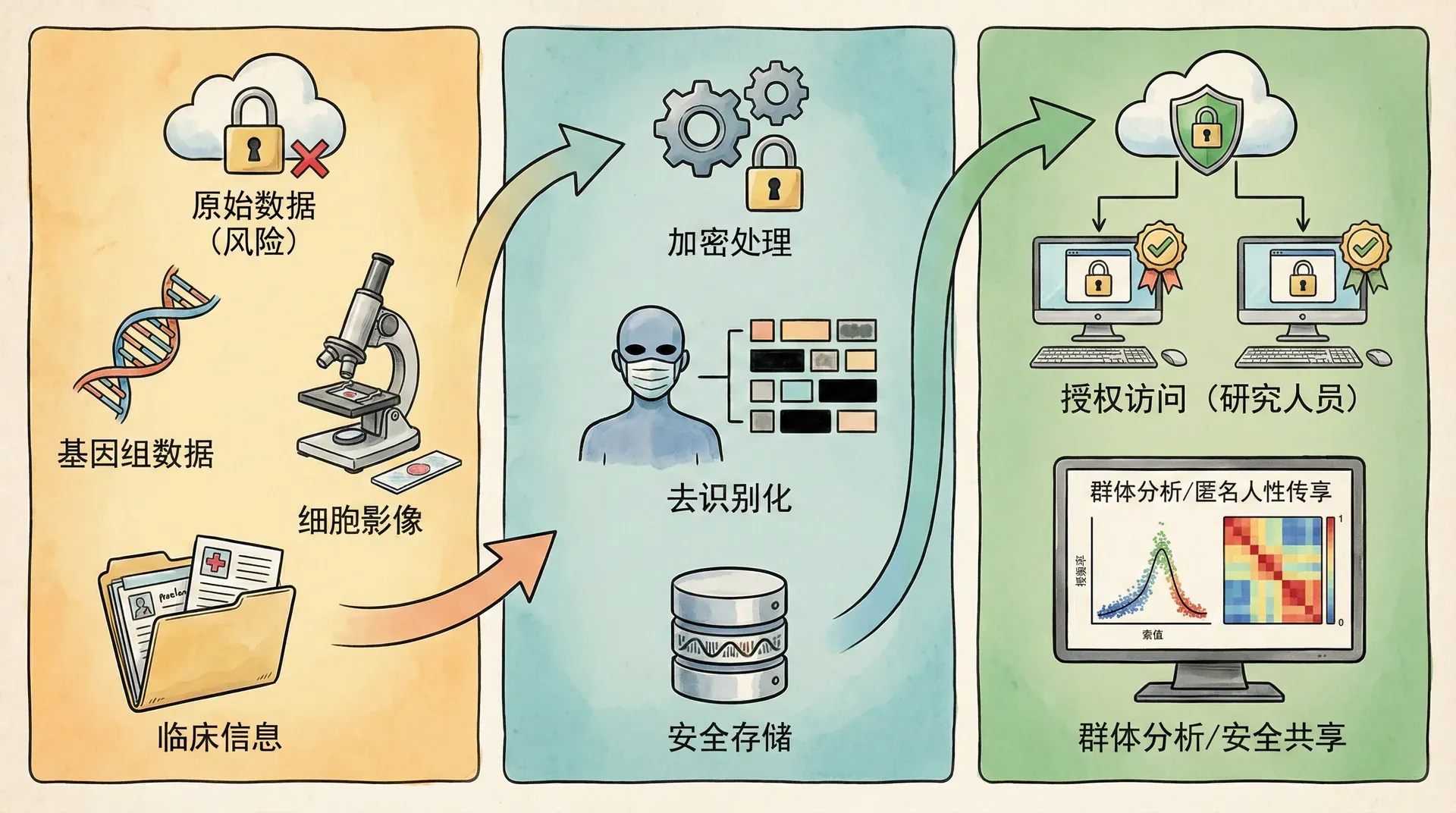
基因数据的共享策略与技术路径
基因及临床数据整合带来的科学价值巨大,但也伴随个人隐私、数据安全挑战。为平衡科研开放与隐私保护,中国采取“分级分类+技术防护+动态监管”多重策略:
- 分级分类开放
数据类型可依据敏感度和用途大致分类,部分数据可无条件开放,部分脱敏处理后开放,重要和敏感人群/疾病数据以及可溯源的个体数据则需层层审批,甚至永久内控。下表为常见数据类型与开放策略示例:
- 新兴隐私保护技术
近年来,部分平台积极引入区块链、联邦学习、多方安全计算(MPC)等前沿手段,实现数据在“不出本地”的基础上进行模型训练、联合分析。
依托这些分层授权与新兴技术,中国已建设如中国人类变异数据库(CNGD)、中国罕见病联盟资源库、中国队列研究支持平台等数十个开放与半开放数据库与服务平台,支撑多中心、多学科重大合作项目,加速了疾病基因发掘、群体健康分析等前沿突破。
法律法规及伦理审查制度
为确保数据合规流转和伦理安全,近年来我国陆续出台了多部相关法规及行业标准,尤其强化了跨境流动、第三方使用、知情同意等敏感环节的监管。例如:
实际操作中,样本库和数据平台普遍设立独立伦理审查委员会,重点审查涉及高风险人群/疾病、国际数据交互、商业转化等项目,并要求科研团队在数据调取前取得知情同意书和伦理备案,防范数据滥用与隐私泄漏。以此为基础,我国正逐步实现“守法合规、安全可控、科学高效”的生物资源管理新局面,为基因组学未来创新提供坚实保障。
基因组学的未来发展
随着测序成本的进一步降低,未来每个人或将拥有属于自己的全基因组信息“数字生命档案”。这不仅有助于人生早期进行全程健康管理和疾病风险预测,还能推动新药研发和罕见遗传病的精准筛查。
在临床领域,基因数据将被精选性地与电子病历、影像、代谢等多种健康数据深度整合,成为智慧医疗的核心驱动力。政府、医疗机构与企业协同,推动全国健康档案互通及精准医疗下沉,遗传咨询、罕见病诊疗和个性化用药服务也将加速普及。
人工智能结合大规模、动态的人群基因组和表型数据,能够精选并高效识别个体疾病风险和药物响应特征,推动“千人千面”的个性化诊疗。医生可更精准地制定用药方案,企业则能够提供定制药物、伴随诊断等多样化创新服务。基因组变异研究正精选性地推动生命科学进步,并与全民健康息息相关。随着科技进步、政策完善和社会广泛参与,基因组学将在疾病防控、健康管理及老龄化应对等方面发挥更深远作用,为国民健康与医疗创新开辟更广阔前景。